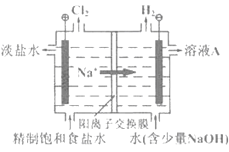
-
下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A. ②③④ B. ②④⑤⑦ C. ①②③④⑥ D. ①③⑤⑥
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是
Ts
难度: 中等查看答案及解析
-
下列指定粒子的个数比为2∶1的是( )
A. BaO2(过氧化钡)固体中的阴离子和阳离子 B.
原子中的中子和质子
C. NaHCO3固体中的阳离子和阴离子 D. Be2+中的质子和电子
难度: 简单查看答案及解析
-
以下有关原子结构及元素周期律、元素周期表的叙述正确的是( )
A. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
B. 元素周期表有十八个纵行,共十六个族
C. 第 ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D. 在元素周期表的金属和非金属分界线附近寻找优良的催化剂
难度: 简单查看答案及解析
-
已知氧的同位素160、17O、18O,氢的同位素有H、D、T,从水分子的原子组成来看,自然界的水一共有( )
A. 18种 B. 15种 C. 12种 D. 9种
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
①质子数相同的粒子一定是同一种元素;②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子;③电子数相同的粒子不一定是同种元素;④一种元素不可能形成不同单质;⑤某元素的相对原子质量就是质量数
A. ②④⑤ B. ①④⑤ C. ②③④ D. ①②③⑤
难度: 中等查看答案及解析
-
如图为元素周期表前4周期一部分,且X、Y、Z、R和W为主族元素。下列说法中正确的是( )
X
Y
Z
R
W
A. 五种元素一定都是非金属元素
B. 五种元素的原子最外层电子数一定都大于2
C. X的氢化物的稳定性比Z的氢化物的稳定性弱
D. R的最高价氧化物对应水化物一定是强酸
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2—和Z—,Y+ 和Z—具有相同的电子层结构。下列说法正确的是( )
A. 原子最外层电子数:X > Y > Z B. 单质的氧化性:X > Z > Y
C. 离子半径:X2—> Y+ > Z— D. 原子序数:X > Y > Z
难度: 简单查看答案及解析
-
下列有关物质性质的比较正确的是( )
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐降低;②元素的非金属性越强,气态氢化物的热稳定性越弱;③单质与水反应的剧烈程度:F2>Cl2>Br2>I2;④元素非金属性越强,它的气态氢化物水溶液的酸性越强;⑤还原性:S2->Se2-;⑥碱性:NaOH>Mg(OH)2
A. ①③ B. ②④ C. ③⑥ D. ⑤⑥
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期。Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A. X的氢化物溶于水显酸性 B. Y的氧化物是离子化合物
C. Z的氢化物的水溶液在空气中存放不易变质 D. X和Z的最高价氧化物对应的水化物都是弱酸
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 共价化合物中不可能含有离子键,一定含有共价键
B. 阴阳离子之间通过静电引力形成的化学键叫离子键
C. 含有共价键的化合物不一定是共价化合物
D. 含有离子键的化合物一定是离子化合物
难度: 简单查看答案及解析
-
化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是( )
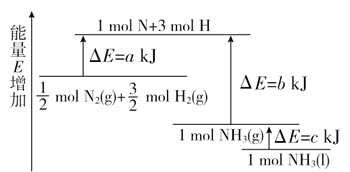
A.
N2(g)+
H2(g)=NH3(l) ΔH=(a-b-c) kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a) kJ/mol
C.
N2(g)+
H2(g)=NH3(l) ΔH=(b+c-a) kJ/mol
D.
N2(g)+
H2(g)=NH3(g) ΔH=(a+b) kJ/mol
难度: 简单查看答案及解析
-
已知:CH3COOH(aq) + NaOH(aq)= CH3COONa(aq)+H2O(l) △H=Q1 kJ/mol
H2SO4(浓) +
NaOH(aq)= Na2SO4(aq)+H2O(1) △H=Q2 kJ/mol
HNO3(aq) + KOH(aq)= KNO3(aq)+H2O(1) △H=Q3 kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
A. Q1=Q2=Q3 B. Q2 >Q1 >Q3 C. Q2 >Q3 >Q1 D. Q2 =Q3 >Q1
难度: 简单查看答案及解析
-
已知反应:①2C(s)+ O2(g)= 2CO(g) △H=﹣221 kJ/mol
②稀溶液中,H+(aq)+ OH﹣(aq)= H2O(l) △H=﹣57.3 kJ/mol
下列结论正确的是( )
A. 碳的燃烧热是110.5 kJ/mol
B. 反应①的反应热为221 kJ/mol
C. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
D. 稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A. NaCl[盐酸] B. NaOH[H2O] C. CuCl2[HCl] D. CuSO4[Cu(OH)2]
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 电解质溶液导电的过程实际上就是电解的过程
B. 氢氧燃料电池的负极反应式 :O2+2H2O+4e-=4OH-
C. 粗铜精炼时,电解质溶液中铜离子浓度保持不变
D. 铁与稀H2SO4反应时,加入过量CuSO4溶液,可使反应速率加快
难度: 简单查看答案及解析
-
如图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02 mol电子通过,下列叙述中正确的是( )

A. 甲烧杯中A极上最多可析出铜0.64g
B. 乙烧杯中滴入酚酞试液,D极附近先变红
C. 甲烧杯中B极上电极反应式:4OH--4e-=2H2O+O2↑
D. 烧杯中C极上电极反应式为:4H++4e-=2H2↑
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 用惰性电极电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B. 用惰性电极电解稀NaOH溶液,要消耗OH-,故溶液的pH减小
C. 用惰性电极电解Na2SO4溶液,在阴极和阳极上析出产物的物质的量之比为2∶1
D. 原电池是将电能转化为化学能的装置
难度: 简单查看答案及解析
-
某兴趣小组学生设计水果电池:把锌片和铜片用导线连接好,然后将锌片和铜片平行插入新鲜西红柿中,再在导线中接一个灵敏电流计,指针发生偏转,将西红柿换成橘子后重新做实验,发现电流计指针没有发生偏转。下列针对该组实验的说法正确的是( )
A. 通过对比实验说明西红柿汁是电解质溶液而橘子汁是非电解质溶液
B. 通过对比实验得出西红柿汁pH<7,橘子汁pH>7
C. 用橘子探究原电池工作原理的实验不可能获的成功
D. 通过对比实验说明构成原电池条件之一是:两极要和电解质溶液接触并形成闭合回路
难度: 简单查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
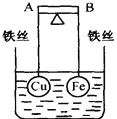
A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
D. 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
难度: 简单查看答案及解析