-
下列有关叙述错误的是
A.化学反应均伴随着能量的变化
B.需要加热才能发生的反应不一定是吸热反应
C.物质的化学能可以在一定条件下转化为热能、电能为人类利用
D.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,不正确的是:

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+
D.装置③中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
B.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
C.已知:①2H2(g) +O2(g) =2H2O(g) △H=-a kJ·mol-1,
②2H2(g)+O2 (g)= 2H2O(1) △H=-b kJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2 (g)=CO2(g) △H=- 393.5kJ·mol-1,
②C(s,金刚石)+O2(g)=CO2 (g) △H=- 395.0 kJ·mol-1
则C(s,石墨)=C(s,金刚石) △H= -1.5 kJ·mol-1
难度: 中等查看答案及解析
-
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中错误的是
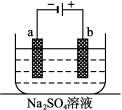
A.a电极附近呈蓝色,b电极附近呈红色
B.a电极附近呈红色,b电极附近呈蓝色
C.逸出气体的体积,a电极的大于b电极的
D.a、b两电极都逸出无色无味气体
难度: 中等查看答案及解析
-
在测定中和反应反应热的实验中,下列叙述错误的是
A.向量热计中加入盐酸,搅拌后的温度为初始温度
B.实验中可使酸或碱略过量
C.向量热计中加碱液时,碱液的温度应与酸的温度相同
D.可以用氢氧化钾代替氢氧化钠,浓硫酸代替盐酸
难度: 中等查看答案及解析
-
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- =2Ag +2OH-。下列说法错误的是
A.溶液中OH-向正极移动
B.锌发生氧化反应
C.氧化银是正极
D.在电池放电过程中,电解质溶液的碱性增强
难度: 中等查看答案及解析
-
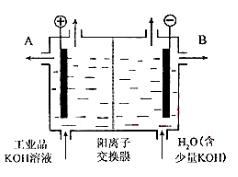
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是:
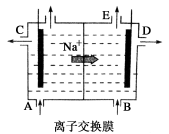
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO等离子,精制时先加Na2CO3溶液
难度: 中等查看答案及解析
-
如图所示,装置中都盛有0.1mol·L-1 的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是:( )

A.①②③④ B.①②④③ C.②①④③ D.③①④②
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
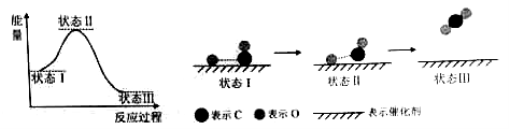
下列说法中正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 困难查看答案及解析
-
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是

A. B. C. D.
难度: 中等查看答案及解析
-
普通锌锰干电池的外壳是锌筒,内置一个碳棒作电极,工作时发生的反应为:

下列有关说法不正确的是
A.干电池的负极是锌筒 B.MnO2在碳棒上发生还原反应
C.闲置时间过长干电池也会失去供电能力 D.工作时电解液中的NH4+移向负极
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.热化学方程式中的化学计量数表示物质的量,可以是分数
B.应用盖斯定律可计算某些难以直接测量的反应焓变
C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
D.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为285.8 kJ/mol
难度: 中等查看答案及解析
-
如图装置分别通电一段时间后,溶液的质量增加的是
A.
 B.
B. C.
C. D.
D.
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中溶液的酸性均减弱
B.产生气泡的速度甲比乙快
C.两烧杯中铜片表面均无气泡产生
D.甲中铜片是正极,乙中铜片是负极
难度: 中等查看答案及解析
-
根据下图,可判断出下列离子方程式中错误的是
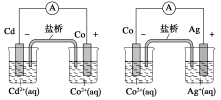
A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
难度: 中等查看答案及解析
-
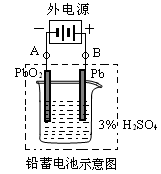
下列叙述正确的是
A.电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应
B.铅蓄电池放电时,负极质量减轻,正极质量增加
C.马口铁(镀锡铁)镀层破损后即失去保护作用
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e- == Fe3+
难度: 简单查看答案及解析
-
CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是

A.正极反应AgCl +e- = Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析


 设计的原电池如图所示。
设计的原电池如图所示。