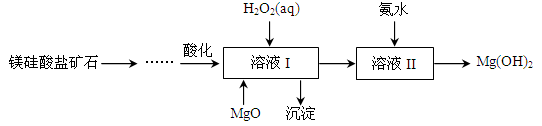
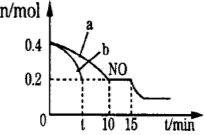
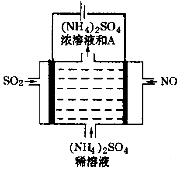
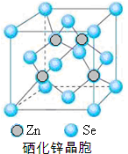
-
化学与社会、科学、技术、环境等有密切联系。下列有关说法正确的是
A.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
B.PM 2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C.新型材料聚酯纤维、光导纤维都属于有机高分子
D.在食品袋中放入盛有硅胶的透气袋,可防止食物氧化变质
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下
列说法正确的是
A.80 mL10 mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA
B.通入了1 mol Cl2的新制氯水中,HC1O、Cl-、C1O-粒子数之和为2NA
C.1 mol Na2O2中含有的阴离子数为2 NA
D.标准状况下,4.48L NH3中共用电子对数为0.6 NA
难度: 简单查看答案及解析
-
某有机物分子式为C4H8,据此推测其结构和性质均正确的是
A.它与乙烯一定是同系物
B.它一定能使溴水褪色
C.它的一氯代物可能只有一种
D.等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中
有红棕色气体产生,石灰水变浑浊
有NO2和CO2产生
B
加热盛有NH4Cl固体的试管
试管底部固体消失,试管口有晶体凝结
NH4Cl固体可以升华
C
向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液
加入淀粉后溶液变成蓝色
氧化性:Cl2 > I2
D
蔗糖中滴加浓硫酸并不断搅拌
产生黑色蓬松多孔固体
浓硫酸具有吸水性和强氧化性
难度: 中等查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A. X单质可以通过铝热法获得
B. X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
C. Y的氧化物是良好的半导体材料
D. Z的氢化物比W的氢化物更稳定
难度: 简单查看答案及解析
-
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
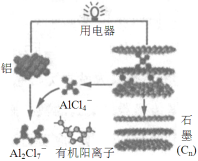
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e-+ 7AlCl4-= 4Al2Cl7-
D.充电时,AlCl4-向石墨电极方向移动
难度: 简单查看答案及解析
-
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20. 00mL浓度均为0.l000mol/L的两种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是
数据编号
滴入NaOH(aq)
的体积/mL
溶液的pH
HX
HY
①
0
3
1
②
a
7
x
③
20.00
>7
y
A.在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B.由表中数据可估算出Ka(HX)≈10-5
C.HY和HX混合,c(H+)=c(X一)+c(Y一)+c(OH一)
D.上述②反应后的HY溶液中:c(Na+)>c(Y一)>c(OH一)>c(H+)
难度: 简单查看答案及解析