-
工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+  Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O  [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:
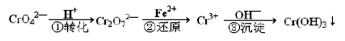
① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如图所示装置进行实验。
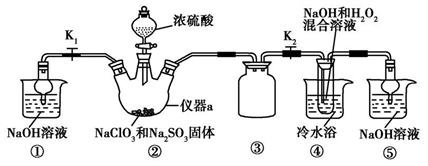
(1)仪器a的名称为____,装置①的作用是____,装置③的作用是______。
(2)装置②中产生ClO2,涉及反应的化学方程式为________________;装置④中反应生成NaClO2的化学方程式为_______________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,_____________________。
(5)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度_____。(提示:2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于___________(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是____________(填“A” 或“B”);比较P1、P2的大小关系________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=______________ (计算结果保留2位有效数字)。
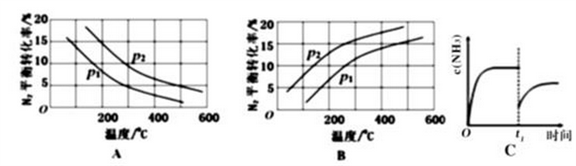
③合成氨反应达到平衡后,t1时刻氨气浓度欲发生图C变化可采取的措施是____________。
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1;2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
-
铁碳合金在现代建筑中占有十分重要的地位。
(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺(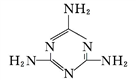 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
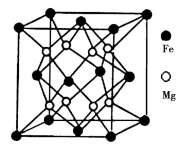
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
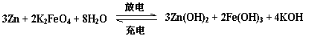 下列叙述错误的是
下列叙述错误的是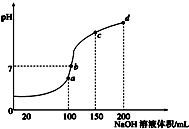
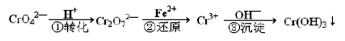




 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。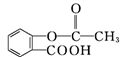 和能放出扑热息痛(
和能放出扑热息痛( )的高分子药物(
)的高分子药物(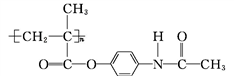 )。
)。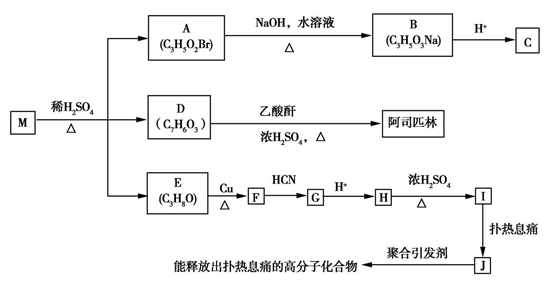
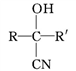
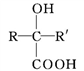 (R、R'表示氢原子或烃基);
(R、R'表示氢原子或烃基);