-
铁碳合金在现代建筑中占有十分重要的地位。
(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺(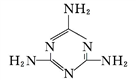 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
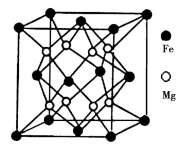
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
-
[化学--物质结构与性质]
第4周期过渡金属元素能形成多种多样的配合物.CO可以和过渡金属形成配合物.
(1)Fe3+离子的电子排布式为______.配合物Fe(CO)5的配位体是______.常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂,熔点为251K,沸点为376K,据此,可判断Fe(CO)5晶体属于______晶体(填“离子”、“原子”、“分子”或“金属”).CO和N2的价电子总数相同,CO和N2相似,分子中都存在一个共价叁键,其中包含______个δ键,______个π键.
(2)一般地说,第4周期元素的第一电离能随原子序数的增大而增大,而31Ga的第一电离能却明显低于30Zn,原因是______.
(3)下表为CO和N2的有关信息.根据表中数据,说明CO比N2活泼的原因:______.
| 化学键 | C-O | C═O | C≡O |
| 键能(kJ/mol) | 351 | 803 | 1071 |
| 化学能 | N-N | N═N | N≡N |
| 键能(kj/mol) | 159 | 418 | 945 |
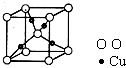
(4)在1个Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目为______.
-
过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
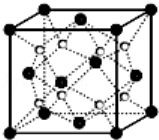
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm.(用含ρ、NA的计算式表示)
3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
-
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,空间构型 。
②基态W原子的核外电子排布式 。
③Y、Z、M三种元素的第一电离能由大到小的顺序为 (用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g) △H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g) △H=+180.5kJ·mol-1
则上述反应的热化学方程式是 。
-
【化学——选修3:物质结构与性质】(15分)过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6] [硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为 。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因 。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x = 。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为 。
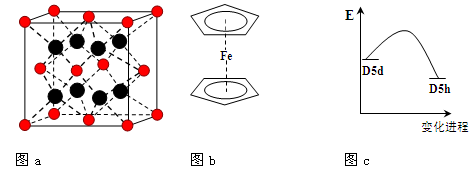
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为 。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有 个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是 结构(填“重叠”或“错位”)。
-
[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe 有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
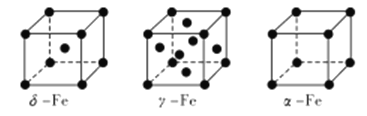
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
② 1个γ晶体晶胞中所含有的铁原子数为_____________。
③ 若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
-
[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe 有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
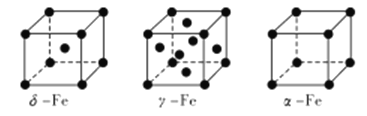
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
② 1个γ晶体晶胞中所含有的铁原子数为_____________。
③ 若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
-
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
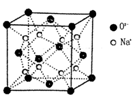
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含 、NA的计算式表示)
、NA的计算式表示)
-
【化学—物质结构与性质】(12分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm(用含ρ、NA的计算式表示)。
-
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
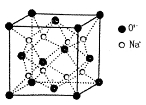
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“•••”分别表示出配位键和氢键。_____
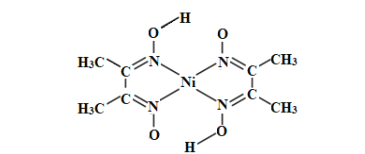
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
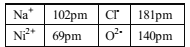
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“ ”)和四面体空隙(“
”)和四面体空隙(“ ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
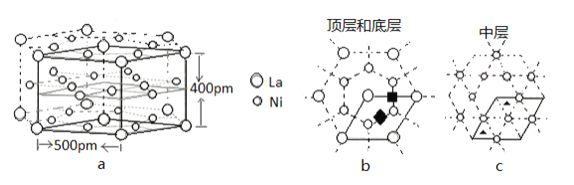
①LaNix合金中x的值为_____;
②晶胞中和“ ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“ ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023, =1.7)
=1.7)

 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。










 =1.7)
=1.7)