-
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,空间构型 。
②基态W原子的核外电子排布式 。
③Y、Z、M三种元素的第一电离能由大到小的顺序为 (用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g) △H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g) △H=+180.5kJ·mol-1
则上述反应的热化学方程式是 。
-
【化学——选修3:物质结构与性质】(15分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
-
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为________。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是________、________;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于(填晶体类型)
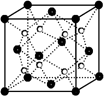
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=________cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是_________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是________。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含________个σ键,________个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:________。
-
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含 、NA的计算式表示)
、NA的计算式表示)
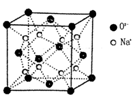
-
(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。
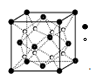
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。
-
【化学—物质结构与性质】(12分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
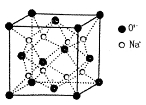
(3)O和Na的一种只含有离子键的化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm(用含ρ、NA的计算式表示)。
-
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为_____________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_________(填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a =_________cm。 (用含ρ、NA的计算式表示)

(3)下列有关的说法正确的是___________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为_______,1mol Y2X2含有σ键的数目为__________。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是____________。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是______________________。
-
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
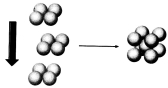
(4)常温条件下,铁的晶体采用如图所示的堆积方式.则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3.
-
铁是最常见的金属材料。铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)〕 和Fe(CO)x等多种配合物。
(1)基态Fe3+的核外电子排布式为_____,与NO3-互为等电子体的分子是__________。
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式依次为______。C、N、O三种元素的第一电离能由大到小的顺序是______。
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
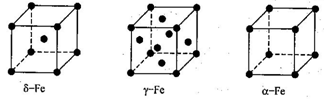
(4)铁有δ、γ、a三种同素异形体,δ、γ、a三种晶胞中铁原子的配位数之比为_______。
-
[化学—选修(三)物质结构与性质](15分)
铁是最常见的金属材料。铁能形成 [Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物。
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______ (填晶体类型)。
(4)常温条件下,铁的晶体采用如图所示的堆积方式。则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3。