-
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
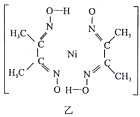
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“•••”分别表示出配位键和氢键。_____
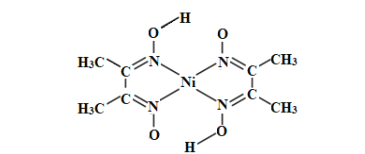
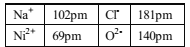
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
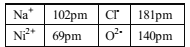
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
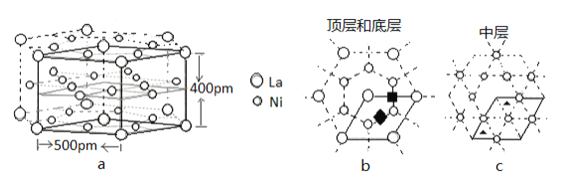
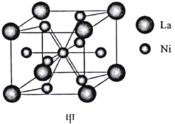
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“ ”)和四面体空隙(“
”)和四面体空隙(“ ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
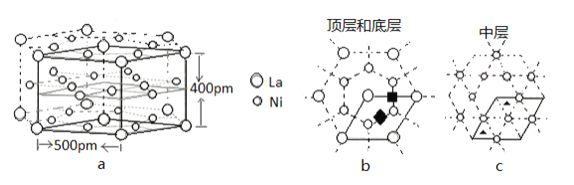
①LaNix合金中x的值为_____;
②晶胞中和“ ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“ ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023, =1.7)
=1.7)
-
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“•••”分别表示出配位键和氢键。_____
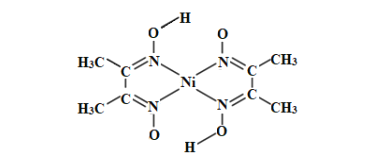
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“ ”)和四面体空隙(“
”)和四面体空隙(“ ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
①LaNix合金中x的值为_____;
②晶胞中和“ ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“ ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023, =1.7)
=1.7)
-
钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与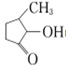 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。
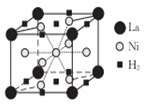
①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(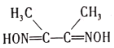 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
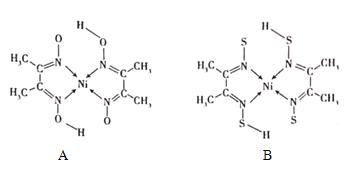
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
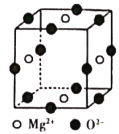
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
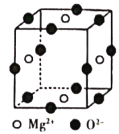
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(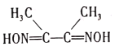 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
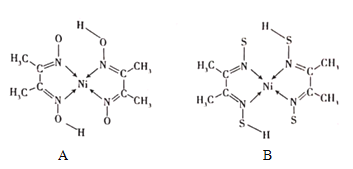
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
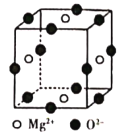
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
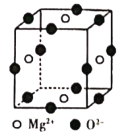
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟( )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
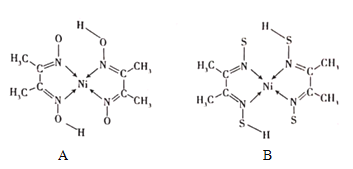
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(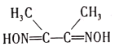 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
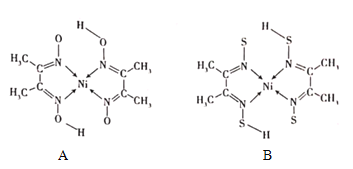
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
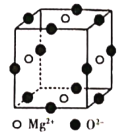
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(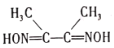 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
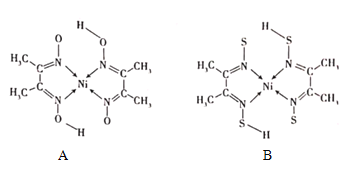
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
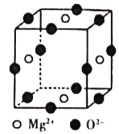
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(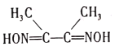 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
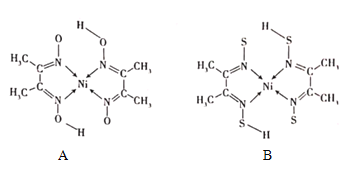
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键 B.金属键 C.配位键 D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
-
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)镍元素基态原子的价电子排布式为________;3d能级上的未成对的电子数为________。
(2)硫酸镍溶于氨水形成 蓝色溶液,
蓝色溶液, 中配体的空间构型是________,阴离子的空间立体构型是________。
中配体的空间构型是________,阴离子的空间立体构型是________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO________FeO(填“ ”或“
”或“ ”)。
”)。
(4)元素铜与镍的第二电离能分别为:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)> I(Ni)的原因是________。
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图甲所示。该合金的化学式为________。
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图乙所示。该结构中,除共价键外还存在配位键和氢键。请在图中用“→”和“…”表示出配位键和氢键。(提示:Ni2+的配位数为4)________。
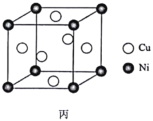
(7)某镍白铜合金的立方晶胞结构如图丙所示。若合金的密度为dg·cm-3,晶胞参数a=________nm。


”)和四面体空隙(“
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

”同类的八面体空隙有___个,和“
”同类的四面体空隙有___个。




 可形成配合物。
可形成配合物。
 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。

 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。

 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。

 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。

 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。

 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。



