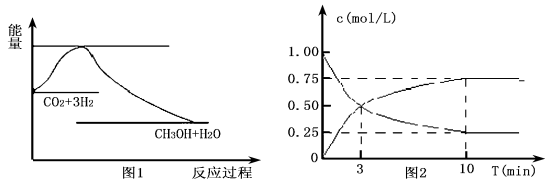
-
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
难度: 中等查看答案及解析
-
下列物质中属于强电解质的是
A.稀硫酸 B.BaSO4 C.Al(OH)3 D.NH3·H2O
难度: 中等查看答案及解析
-
升高温度能加快化学反应速率的主要原因是
A.增加活化分子百分数 B.降低活化分子的能量
C.活化分子能量明显增加 D.降低反应所需的能量
难度: 中等查看答案及解析
-
室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的硫酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
难度: 中等查看答案及解析
-
下列操作会使H2O的电离平衡向电离方向移动且pH<7的是
A.向水中加少量Na2CO3
B.向水中加少量FeCl3
C.向水中加少量NaHSO4
D.向水中加入少量NaCl
难度: 中等查看答案及解析
-
下列各组离子,在所给条件下能够大量共存的是
A.pH=0的溶液中,Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=10-8mol/L的溶液中,K+、HCO3-、Cl-、S2-
C.使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO42-
D.在
溶液中Na+、AlO2-、SO42-、NO3-
难度: 中等查看答案及解析
-
x、y、z为三种气体,把a mol x和b mol y充入一密闭容器中,发生反应,x+2y
2z达到平衡时,若它们的物质的量满足n(x)+n(y)=n(z),则y的转化率为
A.(a+b)/5×100% B.2(a+b)/5b×100%
C.2(a+b)/5×100% D.(a+b)/5a×100%
难度: 中等查看答案及解析
-
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是

A.通入乙醇的电极为该电池的正极
B.放电过程中,电源内部的H+从正极区向负极区迁移
C.该电池的正极反应为:4H++O2+4e—=2H2O
D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L
难度: 困难查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E
C.D>E>A>B D.D>A>B>E
难度: 中等查看答案及解析
-
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
实验编号
c(HA)/mol·L—1
c(NaOH)/mol·L—1
混合溶液的pH
甲
0.1
0.1
pH=a
乙
0.2
0.2
pH=9
丙
c1
0.2
pH=7
丁
0.2
0.1
pH<7
下列判断不正确的是
A.a<9
B.c1<0.2
C.在乙组混合溶液中c(OH—)—c(HA)=10—9 mol/L
D.在丁组混合液中c(Na+)<c(A—)
难度: 中等查看答案及解析
-
已知H2(g)+1/2O2(g) =H2O(l);△H= -285.8 kJ·molˉ1
CO(g)+1/2O2(g)=CO2 (g);△H= -282.9 kJ·molˉ1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
A.2∶1 B.1∶2 C.1∶1 D.2∶3
难度: 中等查看答案及解析
-
用铂电极电解100mL HNO3 与 AgNO3 的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为
A、1mol·L-1 B、2 mol·L-1
C、2.5 mol·L-1 D、3 mol·L-1
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)
K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.②⑥ B.①②③ C.②⑤⑥ D.①③④⑤
难度: 中等查看答案及解析
-
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-)
B.c(HSO3-) + c(SO32-) = 0.1mol·L-1
C.c(SO32-) < c(H2SO3)
D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-)
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是

A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+ O2(g)
2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
难度: 困难查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)
2XY3(g),△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
X2
Y2
XY3
①
1
3
0
放热 23.15 kJ
②
0.6
1.8
0.8
Q(Q>0)
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
难度: 困难查看答案及解析
-
已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出
B.往氯化银的悬浊液中加硝酸银,c(Cl—)、c(Ag+)均减小
C.由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小
难度: 中等查看答案及解析
-
C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列相等的是
A.2个-CH3,能生成6种一氯代物
B.3个-CH3,能生成4种一氯代物
C.2个-CH3,能生成5种一氯代物
D.4个-CH3,能生成4种一氯代物
难度: 中等查看答案及解析
-
某有机化合物的结构简式为:
;其中属于芳香醇的同分异构体共有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析