-
食物的选择与其酸碱性关系很大.下列食物中,属于酸性食物的是( )
A.柠檬
B.黄瓜
C.萝卜
D.鸡蛋难度: 中等查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是( )
A.蔗糖水
B.食盐水
C.豆浆
D.小苏打水难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.甲烷、乙烯和苯都可通过石油分馏得到
B.只用淀粉溶液即可检验食盐是否为加碘盐
C.利用油脂在碱性条件下的水解反应可以制肥皂
D.利用变性后可以再溶解的性质可分离提纯蛋白质难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.在船舶的外壳装上铜块可防止其发生电化学腐蚀
B.MnO2、FeCl3和CuSO4都可加快H2O2的分解速率
C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3
D.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg难度: 中等查看答案及解析
-
下列有关0.1mol•L-1NaHCO3溶液中离子浓度的关系式,正确的是( )
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)难度: 中等查看答案及解析
-
已知某强酸性溶液中存在较多的Ba2+、NO3-,则溶液中还可能大量存在的离子组是( )
A.K+、NH4+、HCO3-
B.Fe2+、Ca2+、Cl-
C.Cu2+、Mg2+、SO42-
D.Na+、Cu2+、Cl-难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.IA族元素,其原子半径越大金属性越弱
B.核外电子排布相同的两种微粒,化学性质一定相同
C.氨基酸具有两性,则多肽及由多肽形成的蛋白质均具有两性
D.苯分子具有不饱和性,苯与乙炔一样都可使酸性高锰酸钾溶液褪色难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
A.氧化铝的熔点很低,不能用于制作耐高温材料
B.在海轮外壳上镶入锌块,会加快船体的腐蚀速率
C.硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂
D.氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料难度: 中等查看答案及解析
-
下列有关环境保护的说法中,不正确的是( )
A.劣质装修材料中的甲醛、苯、氡气等对人体有害
B.工业生产大量排放二氧化硫是全球气候变暖的主要原因
C.含氮、磷化合物的生活污水大量排放会使水体富营养化
D.废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染难度: 中等查看答案及解析
-
下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 ⑥KSCN溶液可以检验Fe3+离子( )
A.①④⑤⑥
B.②③④⑤
C.①③④⑤
D.①②⑤⑥难度: 中等查看答案及解析
-
下列关于电解的说法中,正确的是( )
A.电解池是把化学能转变为电能的装置
B.电解精炼铜时,粗铜板做阴极
C.电镀时,通常把待镀的金属制品做阴极
D.工业电解饱和食盐水用于生产金属钠和氯气难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
D.食醋除水垢中的碳酸钙:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑难度: 中等查看答案及解析
-
100mL 0.1mol/L的盐酸与50mL 0.2mol/L的氨水混合,充分反应后,所得溶液中各种离子浓度关系正确的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)+c(Cl-)=c(NH4+)+c+c(OH-)难度: 中等查看答案及解析
-
下列有机化合物分子中的所有碳原子不可能处于同一平面的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示.下列说法中,正确的是( )
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强难度: 中等查看答案及解析
-
下列有关化学实验的叙述中,正确的是( )
A.中和滴定实验中应用待测液润洗锥形瓶
B.蒸馏操作时应将温度计的水银球插入液面下
C.用重结晶的方法提纯苯甲酸时应趁热过滤
D.NaOH溶液应保存在带玻璃塞的试剂瓶中难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.1mol过氧化钠中阴离子所带的负电荷数为6.02×1023
B.14g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023
C.28gC16O与28gC18O中含有的质子数均为14×6.02×1023
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023难度: 中等查看答案及解析
-
图所示的实验装置或操作不能达到实验目的是( )

A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.0.1 mol•L-1CH3COOH溶液加水稀释,n(H+)增大
B.0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3)难度: 中等查看答案及解析
-
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
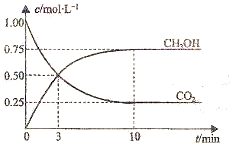
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075mol•L-1•min-1难度: 中等查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )

A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol甲烷分子所含质子数为10NA
B.18g2H2O中所含的电子数为10NA
C.24g镁的原子最外层电子数为NA
D.标准状况下,22.4L乙醇的分子数为NA难度: 中等查看答案及解析
-
对于在恒容、恒温密闭容器中进行的反应H2(g)+I2(g)
2HI(g),能说明其达到化学平衡状态的是( )
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.同时间内生成的H2、I2的物质的量相同难度: 中等查看答案及解析
-
已知某元素的氧化物的相对分子质量为40,其相同价态氯化物的相对分子质量为95,则该元素的化合价为( )
A.-2
B.+1
C.+2
D.+3难度: 中等查看答案及解析
-
如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
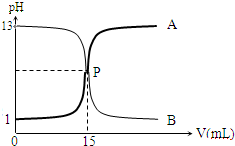
A.盐酸的物质的量浓度为1mol•L
B.P点时反应恰好完全,溶液早中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂难度: 中等查看答案及解析
-
Mg(ClO3)2在农业上常用作脱叶剂、催熟剂,可采用复分解反应制备:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl.已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:下列叙述正确的是( )

A.四种化含物的溶解度随温度变化最小的是Mg(ClO3)2
B.300K时,MgCl2的溶解度约为55g
C.300K时,100gNaCl饱和溶液中约含有NaCl 36g
D.该反应能够进行的条件是生成了沉淀,该沉淀是Mg(ClO3)2难度: 中等查看答案及解析

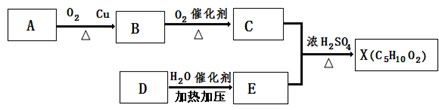
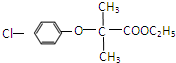 :和某聚碳酸酯工程塑料(
:和某聚碳酸酯工程塑料(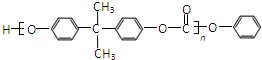 )的原料之一.
)的原料之一.