-
(4分)(2012•广东)化学与生活息息相关,下列说法不正确的是( )
A.用食醋可除去热水壶内壁的水垢
B.淀粉、油脂和蛋白质都是高分子化合物
C.自行车钢架生锈主要是电化学腐蚀所致
D.新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮
难度: 中等查看答案及解析
-
(4分)(2012•广东)在水溶液中能大量共存的一组离子是( )
A.Fe2+、Al3+、ClO﹣、Cl﹣ B.K+、Cu2+、OH﹣、NO3﹣
C.NH4+、Na+、Br﹣、SO42﹣ D.Mg2+、H+、SiO32﹣、SO42﹣
难度: 中等查看答案及解析
-
(4分)(2012•广东)下列实验能达到目的是( )
A.用溴水鉴别苯和正已烷
B.用BaCl2溶液鉴别SO42﹣与SO32﹣
C.用浓HNO3与Cu反应制备NO2
D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
难度: 中等查看答案及解析
-
(4分)(2012•广东)下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
难度: 中等查看答案及解析
-
(4分)(2012•广东)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,4g CH4含nA个C﹣H共价键
B.1 mol Fe与足量稀HNO3反应,转移个2nA个电子
C.1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3﹣
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
难度: 中等查看答案及解析
-
(4分)(2012•广东)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
SO2有漂白性
SO2可使溴水褪色
B
SiO2有导电性
SiO2可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
(6分)(2012•广东)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
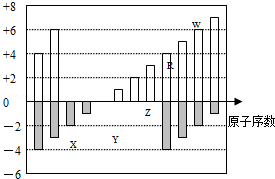
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
(6分)(2012•广东)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl﹣)+c(OH﹣)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10﹣12 mol•L﹣1
D.与等体积0.01 mol•L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣)
难度: 中等查看答案及解析