-
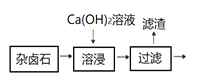
(17分)(2012•广东)难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
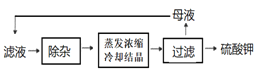
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:

(1)滤渣主要成分有 和 以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: .
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性.
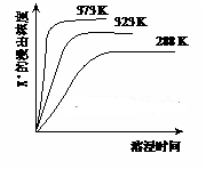
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,① ② ;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K (计算结果保留三位有效数字).
-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
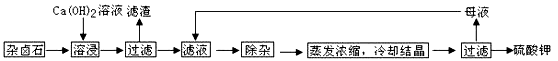
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
_____________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
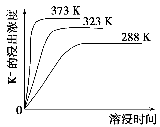
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①_______________________________________________________,
②_______________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO
CaCO3(s)+SO
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO (aq)+2H2O
(aq)+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入 ________溶液调滤液pH至中性。
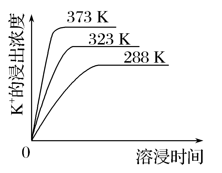
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,①___,
②_________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)
(aq)
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。_________
-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。

(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+
 CaCO3(s)+
CaCO3(s)+
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
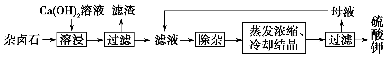
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
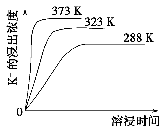
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32— CaCO3(s)+SO42—
CaCO3(s)+SO42—
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
-
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡

为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有_______和_______以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
____ 。
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入_______溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高,
①________________________②_______________

(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
 已知298K时,Ksp(CaCO3)
已知298K时,Ksp(CaCO3)
=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(计算结果保留三位有效数字)。
-
难溶性杂卤石属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O(s)⇌2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
(1)滤渣主要成分有______和______以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:______.
(3)“除杂”环节中,先加入______溶液,经搅拌等操作后,过滤,再加入______溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①______②______;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ⇌CaCO3(s)+
⇌CaCO3(s)+
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K______ (计算结果保留三位有效数字).
-
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)在水中存在如下平衡K2SO4•MgSO4•2CaSO4•2H2O (s) 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
-
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是

A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动
B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动
C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-)
D.升高温度,反应速率增大,平衡向正反应方向移动
-
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s) 2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是
2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是
A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动
B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动
C.升高温度,反应速率增大,平衡向正反应方向移动
D.该平衡的Ksp= c(Ca2+) ·c(K+)·c(Mg2+)·c(SO42-)
+2H2O

⇌CaCO3(s)+











 已知298K时,Ksp(CaCO3)
已知298K时,Ksp(CaCO3)




