-
下列物质属于纯净物的是
A. 液氯 B. 漂白粉 C. 盐酸 D. 碘酒
难度: 简单查看答案及解析
-
下列化合物中所有化学键都是共价键的是
A.Na2O2 B.NaOH C.BaCl2 D.H2SO4
难度: 中等查看答案及解析
-
下列关于指定粒子构成的描述不正确的是
A. 37Cl与39K具有相同的中子数
B. 第114号元素的一种核素298114X与82Pb具有相同的最外层电子数
C. H3O+与OH-具有相同的质子数和电子数
D. O22-和S2-具有相同的质子数和电子数
难度: 简单查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是:
A. 质子数为17、中子数为20的氯原子
B. 氯离子(C1-)的结构示意图
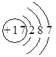
C. 氯气分子的电子式
D. 氯乙烯分子的结构简式H3C-CH2Cl
难度: 简单查看答案及解析
-
下列关于电子式的表述正确的是:
A. NaClO的电子式为
B. SCl2的电子式为
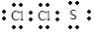
C. 用电子式表示HCl的形成过程为:H+
→
D. 已知SCN-中每个原子都达到8电子结构,则其电子式为
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A. 稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O
B. NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-
C. FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl-
D. AICl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
难度: 困难查看答案及解析
-
下列叙述中,排列顺序正确的是:
①氧化性:KMnO4>MnO2>Cl2 ②单质的密度:Na<K<Rb ③微粒半径:K+>S2->F- ④物质的熔点:Li>Na>K ⑤氢化物的沸点:H2Se>H2S>H2O
A. ①③ B. ②④ C. ①④ D. ③⑤
难度: 中等查看答案及解析
-
下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在pH = 1的溶液中:SO
、Cl−、NO
、Na+
B.在能使酚酞变红的溶液中:Na+、Cl−、NO
、K+
C.在1 mol·L-1的NaAlO2溶液中:K+、Ba2+、SO
、OH−
D.在1 mol·L-1的AlCl3溶液中:NH
、Ag+、Na+、NO
难度: 中等查看答案及解析
-
下列关于铁电极的说法中,正确的是
A. 钢铁的吸氧腐蚀中铁是正极 B. 在铁片上镀铜时铁片作阳极
C. 电解饱和食盐水时可用铁作阴极 D. 镀锌铁板发生电化学腐蚀时铁是负极
难度: 简单查看答案及解析
-
下列热化学方程式中的反应热能表示标准燃烧热的是(a、b、c、d均大于0):
A. C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-a kJ·mol-1
B. CH3CH2OH(l)+O2(g)===CH3CHO(l)+H2O(l) ΔH=-b kJ·mol-1
C. C(s)+O2(g)===CO(g) ΔH=-c kJ·mol-1
D. NH3(g)+O2(g)===NO(g)+H2O(g) ΔH=-d kJ·mol-1
难度: 简单查看答案及解析
-
下列有关说法中错误的是
A.氢氟酸不能盛放在玻璃试剂瓶中
B.玻璃、水晶、陶瓷的主要成分均是硅酸盐
C.灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应
D.由沙子制备光伏材料时的反应之一为SiO2+2C
Si+2CO↑
难度: 简单查看答案及解析
-
X、Y是元素周期表中第ⅦA族的两种元素。下列叙述中能说明X的非金属性比Y强的是:
A. X原子的电子层数比Y原子的电子层数多
B. X的氢化物的沸点比Y的氢化物的沸点低
C. X的气态氢化物比Y的气态氢化物稳定
D. Y的单质能将X从NaX溶液中置换出来
难度: 中等查看答案及解析
-
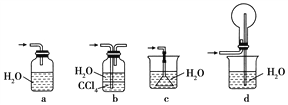
下列有关操作不可能引发喷泉现象的是:
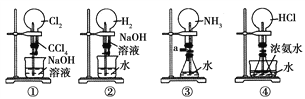
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C. 打开止水夹,用鼓气装置从装置③的a处不断鼓入空气
D. 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是:
A. 单质的沸点:W>X B. 氧化物的水化物的酸性:Y<Z
C. 阴离子的还原性:W>Z D. X与Y不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
B. 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
C. 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子
D. 1.0L 1.0 mol·L-1Na2SiO3水溶液中含有的氧原子数为3NA
难度: 中等查看答案及解析
-
向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是:
A. 白色沉淀是FeSO3
B. 白色沉淀是BaSO3和BaSO4的混合物
C. 白色沉淀是BaSO4
D. FeCl3已全部被SO2氧化成FeCl2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
难度: 简单查看答案及解析
-
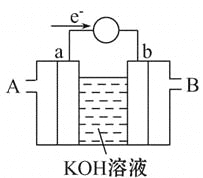
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu。下列说法错误的是:
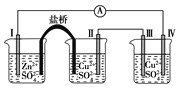
A. 电极Ⅰ发生氧化反应
B. 相同时间内,电极Ⅱ与电极Ⅳ的质量变化值相同
C. 电极Ⅲ的电极反应:4OH--4e-===O2↑+2H2O
D. 电流方向:电极Ⅳ→电流计→电极Ⅰ
难度: 中等查看答案及解析
-
在给定条件下,下列物质之间的转化能实现的是:
①C
CO2
CO
②Si
SiO2
H2SiO3
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Mg(OH)2
MgCl2(aq)
无水MgCl2
⑤NH3
NO
NO2
HNO3
A. ①③⑤ B. ②③④
C. ②④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
下列叙述正确的是
①向久置于空气中的NaOH溶液中加盐酸时有气体产生 ②浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO2等气体 ③CO2和Na2O2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2④足量的硫单质与64 g铜反应,有2 mol电子发生转移 ⑤蔗糖炭化的演示实验中,浓硫酸既体现了强氧化性又体现了脱水性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
A. ①④⑤ B. ①⑤⑥ C. ②③④ D. ④⑤⑥
难度: 中等查看答案及解析
-
已知:2H2O2(l) === 2H2O(l) + O2(g) ∆H = −98 kJ·mol−1。在含少量I-的溶液中,H2O2分解反应过程为:i.H2O2(l) + I-(aq) ==== H2O(l) + IO-(aq) ∆H1
ii.H2O2(l) + IO-(aq) ==== H2O(l) + O2(g) + I-(aq) ∆H2
下列说法不正确的是
A. ∆H1 + ∆H2 = ∆H
B. I-是H2O2分解反应的催化剂
C. 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量
D. 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol
难度: 中等查看答案及解析
-
如图所示电化学装置,X可能为“锌棒”或“碳棒”,下列叙述错误的是
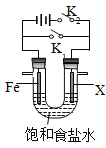
A.X为锌棒,仅闭合K1,Fe电极上发生还原反应
B.X为锌棒,仅闭合K1,产生微量电流方向:Fe→X
C.X为碳棒,仅闭合K2,该电化学保护法称为“牺牲阳极阴极保护法”
D.若X为碳棒,仅闭合K1,铁电极的极反应为:Fe -2e- → Fe2+
难度: 中等查看答案及解析