-
(13分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):

⑴写出反应②的化学方程式________。
⑵反应④中每消耗1 mol G,转移电子的物质的量为________。
⑶反应⑥的离子方程式是。
⑷写出工业冶炼金属乙的化学方程式________。
⑸实验室中保存I的方法是________。
⑹SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是________;H2还原SiCl4过程中若混入O2,可能引起的后果是________。
-
(16分)完成下列各题:
⑴K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车。
①若司机酒后开车,检测仪器内物质显示出________色。
②写出并配平该反应的化学方程式:________。
③如果在反应中生成1mol氧化产物,转移的电子总数为。
⑵在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+ O2(g)=2NO(g) △H=+180. 5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H =________。
②为了提高尾气转化的反应的速率和NO的转化率,采取的正确措施为________。
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
③该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
⑶已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断:①(NH4)2CO3溶液的pH________7(填<、>、=)。
②相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为________。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
-
(15分)
⑴如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
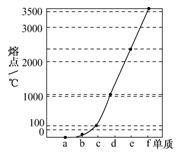
①请写出图中b单质对应元素原子的电子排布式________。
②单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________个σ键和________个π键。
③a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与Ag+之间以________键结合。
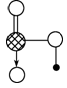
④上图是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:________ 。
⑵碳是形成化合物最多的元素,其单质与化合物广布于自然界。
①与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是________;
②CS2是一种重要的有机溶剂,写出一种与CS2互为等电子体的物质的化学式________;

③冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如上图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有________个水分子,冰晶胞与金刚石晶胞微粒排列方式相同的原因是________。
-
(15分)
经质潜法分析得知,某单烯烃Q的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q分子中有两种化学环境不同的氢原子,氢谱峰面积显示两种氢的原子个数比为1∶3。请回答下列问题:
⑴若Q无顺反异构,则Q的结构简式为________。
⑵在锂离子电池中,需要一种有机聚合物作为正负极之问锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下图所示:

M的合成方法之一如下:

请回答下列问题:
①合成M的反应中,反应I和反应III的反应类型分别是________、________;
试剂Ⅱ是________,C中含有官能团的名称是。
②E的结构简式是________。
③M与足量氯氧化钠溶液反应的化学方程式是________。
⑶D在一定条件下能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式________。
⑷已知:
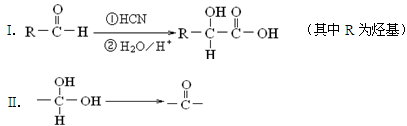
若 ,请写出符合下列条件的物质的一种结构简式________。
,请写出符合下列条件的物质的一种结构简式________。
a.碳骨架与W相同;
b.能发生银镜反应;
c.1mol该物质与足量金属钠作用生成1.5molH2;
d.分子中每个碳原子上不同时连有两个官能团。