-
化学与生产、生活密切相关,下列对有关现象及事实的解释正确的是( )
现象或事实
主要原因
A
燃煤中添加适量CaO可减少SO2排放量
燃烧中硫元素转化为CaSO3
B
聚氯乙烯薄膜不能用于包装食品
会造成白色污染
C
夏天雷雨过后感觉到空气特别的清新
空气中O3含量增加、尘埃减少
D
蒸熟的糯米在适当条件可转化为香甜可口的甜酒
部分淀粉水解生成葡萄糖与乙醇
难度: 简单查看答案及解析
-
现有三种常见治疗胃病药品的标签:

药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较,正确的是( )
A.①=②=③ B.①>②>③
C.③>②>① D.②>③>①
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.浓硝酸与足量铜片反应时,先生成红棕色气体,后生成无色气体
B.浓硫酸具有强氧化性,常温下可将铁、铝的单质氧化
C.饱和氯水既有酸性又有漂白性,加入NaHCO3后漂白性减弱
D.浓盐酸与足量二氧化锰反应后,盐酸有剩余
难度: 困难查看答案及解析
-
阿托酸是一种常用的医药中间体,其结构如图所示:
。下列有关说法中错误的是( )
A.溴单质能与阿托酸发生加成反应
B.阿托酸能与硝酸发生取代反应
C.可用酸性KMnO4溶液区别阿托酸与苯
D.阿托酸分子中含有4个碳碳双键
难度: 中等查看答案及解析
-
相对分子质量为86的某烃M,其分子中含有4个甲基,则A的一氯代物(不考虑立体异构)最多有( )
A.6种 B.5种 C.4种 D.3种
难度: 中等查看答案及解析
-
某溶液中可能含有物质的量浓度相等的下列离子中的几种:Fe3+、Cu2+、Na+、SO42-、CO32-、NO3-、Cl-、I-,取上述溶液少量分别进行如下实验:①一份中加入少量锌粉后,固体溶解、溶液颜色有变化,但无其它现象产生②一份加入BaCl2溶液后得到白色沉淀,下列有关判断正确的是( )
A.溶液中只含Fe3+、SO42-、Cl-
B.溶液中只含Cu2+、SO42-
C.需要利用焰色反应才能确定有无Na+
D.溶液中肯定没有I-,但无法确定有无Cl-
难度: 简单查看答案及解析
-
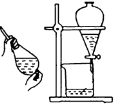
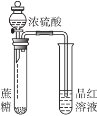
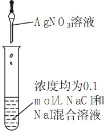
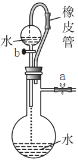
下列有关实验装置、操作,不能实现相应实验目的的是( )
A
B
C
D
装置
目的
用NaOH溶液除去溴苯中单质溴
证明浓硫酸有脱水性、强氧化性
确定Ksp(AgCl)、Ksp(AgI)的相对大小
观察水能否全部流下判断装置气密性
难度: 简单查看答案及解析
-
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是( )
A.一定含有Al,其质量为2.7g
B.一定含有(NH4)2SO4和MgCl2,且物质的量相等
C.一定含有MgCl2和FeCl2
D.一定不含FeCl2,可能含有MgCl2和AlCl3
难度: 中等查看答案及解析
-
铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2=2Cu2O+2SO2,2Cu2O+Cu2S=6Cu+SO2↑;
④电解精炼铜.
下列说法不正确( )
A.上述灼烧过程的尾气回收后可用来制硫酸
B.上述过程中,由6molCuFeS2制取6molCu时共消耗15molO2
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,氧化产物与还原产物的物质的量比1:6
D.在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是( )
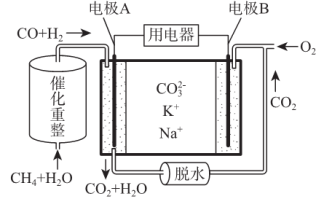
A.反应CH4+H2O
3H2+CO,每消耗1molCH4转移6mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 简单查看答案及解析
-
室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如下图所示。下列说法错误的是( )
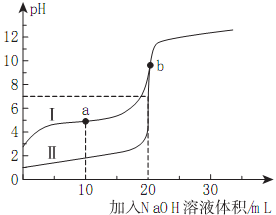
A.当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L
B.滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂
C.a点时的溶液中离子浓度最大的是c(Na+)
D.若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X-与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是( )
A.X、Y间可形成离子化合物
B.单质熔点:Y>W>X
C.最高价氧化物对应水化物的酸性:Z>W
D.Y、W形成的单核离子均能破坏水的电离平衡
难度: 困难查看答案及解析
-
下列叙述正确的是( )
A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B.有机物
的消去(分子内脱水)产物只有1种
C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3
D.可用溴水鉴别已烯、四氯化碳和乙酸
难度: 简单查看答案及解析
-
N2的结构可以表示为
,CO的结构可以表示为
,其中椭圆框表示π键,下列说法中不正确的是( )
A.N2分子与CO分子中都含有叁键
B.CO分子中有一个π键是配位键
C.N2、CO分别由非极性键和极性键结合,因此二者不是等电子体
D.N2与CO的化学性质相同
难度: 简单查看答案及解析
-
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )

A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程④中SO2被氧化
C.从第③步到第⑤步的目的是为了浓缩
D.从能量转换角度看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
难度: 中等查看答案及解析


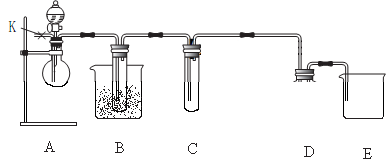
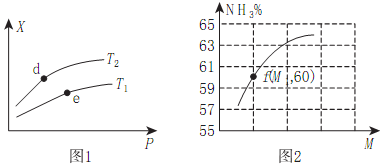
 RCOOH+R1COOH
RCOOH+R1COOH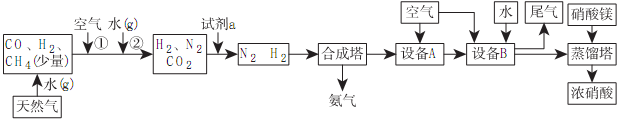
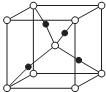 (实心球代表M)
(实心球代表M)