-
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: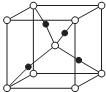 (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
-
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
-
X、Y、Z和W代表原子序数依次增大的4种短周期元素.X元素原子最外层电子数比次外层电子数多1;Z与Y相邻,Z比Y的电子数多8;W元素原子最外层电子数等于电子层数的2倍.下列说法正确的是( )
A.原子半径Y>Z>W
B.Y、Z和W三种元素位于同一周期
C.Y元素最高价氧化物对应的水化物一定是强酸
D.Y、Z的最高正价与最低负价绝对值之和均为8
-
X、Y、Z和W代表原子序数依次增大的4种短周期元素。X元素原子最外层电子数比次外层电子数多1;Z与Y相邻,Z比Y的电子数多8;W元素原子最外层电子数等于电子层数的2倍。下列说法正确的是: ( )
A.原子半径Y > Z > W
B.Y、Z和W三种元素位于同一周期
C.Y元素最高价氧化物对应的水化物一定是强酸
D.Y、Z的最高正价与最低负价绝对值之和均为8
-
X、Y、Z和W代表原子序数依次增大的4种短周期元素。X元素原子最外层电子数比次外层电子数多2;Z与Y相邻,Z比Y的电子数多8;W元素原子最外层电子数等于电子层数的2倍。下列说法正确的是
A.W元素的氧化物对应的水化物一定是强酸
B.Y、Z和W三种元素位于同一周期
C.X、Y、Z和W均为非金属元素
D.X和Y的最简单气态氢化物的稳定性:X>Y
-
A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
(1)写出下列元素的符号:A______B______C______D______,E______;
(2)A与D形成的化合物的化学式为______,其分子的立体构型是______,是______(填“极性”或“非极性”)分子;
(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:______>______>______>______,
其理由是______.
(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是______;
②在晶体中,H3AO3分子能形成这种排列方式的原因是______;
③在H3AO3晶体中层与层之间的作用力是______,该晶体属于______晶体.

-
已知 、
、 、
、 、
、 、
、 都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中
都是元素周期表中前四周期的元素,它们的核电荷数依次增大。其中 与
与 、
、 与
与 在周期表中相邻,
在周期表中相邻, 原子核外有两个未成对电子,
原子核外有两个未成对电子, 的第一电离能比同周期相邻两种元素的都大,
的第一电离能比同周期相邻两种元素的都大, 原子在同周期元素原子中半径最大(稀有气体原子除外);
原子在同周期元素原子中半径最大(稀有气体原子除外); 与
与 位于不同周期,
位于不同周期, 原子核外最外层电子数与
原子核外最外层电子数与 相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
相同,其余各电子层均充满电子。请根据以上信息,回答下列问题。
(1) 、
、 、
、 、
、 四种元素的电负性由大到小的排列顺序为_________。
四种元素的电负性由大到小的排列顺序为_________。
(2) 的氢化物的结构式为_________,其分子的空间构型为________。
的氢化物的结构式为_________,其分子的空间构型为________。
(3) 的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。
的某种化合物的结构如图所示,已知微粒间的相互作用包括化学键和分子间作用力,则此化合物中各种粒子间的相互作用力有___________。

(4) 与
与 的气态氢化物相比,_________(填化学式,下同)的沸点更高;
的气态氢化物相比,_________(填化学式,下同)的沸点更高; 与
与 的气态氢化物相比,________的沸点更高。
的气态氢化物相比,________的沸点更高。
(5) 的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
的稳定氧化物中,中心原子采取________杂化,该氧化物分子的空间构型为______。
-
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X的单质 既有σ键乂有π键,且X的第一电离能比其相邻元素都大,Y的电负性比X的小,其基态 原子最外层的p电子是该层s电子的两倍,Z是前36号元素中原子半径最大的主族元素, W的一种核素的质量数是56,中子数是30。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于________晶体,Z2O2的化学键类型是_______ (填编号)
A.离子键 B.极性共价键 C.非极性共价键 D.金属键
(3)加热条件下,Y的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成 Y的最髙价含氧酸,写出此反应的化学方程式_______.
(4)在250C,101kPa下,W的单质在氧气中燃烧后恢复至原温度和压强,平均每转移 1mol电子放出QkJ的热量,则W单质燃烧的热化学方程式是_______。
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是 。
(2)B的最高价含氧酸根的空间构型为 。
(3)A、B、D三种元素电负性由大到小排列顺序为 。
(4)D单质比化合物DA的熔点 (填“高”或“低”),理由是 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式 。
-
(13分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体 除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是 。
(2)B的最高价含氧酸根的空间构型为 ;
(3)A、B、D三种元素电负性由大到小排列顺序为 。
(4)D单质比化合物DA的熔点 (填“高”或“低”),理由是 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式 。
 (实心球代表M)
(实心球代表M) (实心球代表M)
(实心球代表M)
