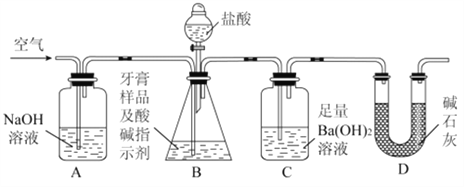
-
化学与生产、生活息息相关。下列叙述错误的是
A. 焊接金属时常用NH4Cl溶液做除锈剂
B. 聚丙烯可用于制造汽车保险杠
C. 双氧水和酒精均可用于消毒杀菌,但原理不相同
D. 普通泡沫灭火器的内筒和外筒均使用钢作材质
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 环氧乙烷的结构简式为
B. N2的电子式为
C. C2H2 的比例模型为
D.
的分子式为C5H7O2
难度: 简单查看答案及解析
-
a、b、c、d 为原子半径依次增大的四种短周期主族元素,其中元素a的最高正价与最低负价的代数和等于0,b、c 能形成摩尔质量相同的两种单质,b、d 则能化合成淡黄色的固体。下列有关判断不正确的是
A. 核电荷数大小:c>d>b>a
B. 简单氢化物的热稳定性:b>c
C. b能分别与a、c、d 形成具有漂白性的物质
D. c 与a 形成的化合物分子中,各原子均达到8 电子稳定结构
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,33.6L氦气所含的原子数目是3NA
B. 2.2 gKHCO3 与Mg3N2 的混合物中含有的质子数目为1.1NA
C. 0.3molNaHSO4固体在熔融状态下所含的SO42-数目为0.3NA
D. 25℃时,1LpH=12 的Na2CO3溶液中含有Na+的数目为0.02 NA
难度: 困难查看答案及解析
-
下列实验操作所对应的现象以及结论都正确的是
选项
实验操作
现象
结论
A
用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热
铝箔熔化并滴落
金属铝的熔点较低
B
先向某溶液滴加H2O2,然后再滴加几滴KSCN 溶液
溶液变为红色
该溶液中一定含有Fe2+
C
在KI 溶液中滴加少量氯水,再加入CCl4,充分振荡
液体分层,下层溶液呈紫红色
氯的非金属性强于碘
D
向1mL 0.1mol/L MgCl2 溶液中先滴1~2 滴2 mol/L NaOH溶液,再滴加2 滴0.1mol/L FeCl3溶液,静置
先有白色沉淀生成,后白色沉淀变为红褐色
Ksp[Mg(OH)2]< Ksp[Fe(OH)3]
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图所示。下列有关说法不正确的是

A. a 为直流电源的正极
B. 阳极室中发生的电极反应式有2Cl--2e-=Cl2↑
C. 电解结束后,阴极室溶液的pH 将降低
D. 若两极共收集到气体13.44 L( 标准状况),混合溶液可除去尿素7.2g (忽略气体的溶解)
难度: 中等查看答案及解析
-
已知常温时HClO 的Ka=3.0×10-8,HF 的Ka= 3.5×10-4。现将pH 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH 随溶液体积的变化如图所示。下列叙述正确的是
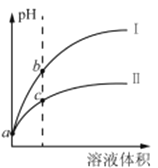
A. 曲线I为次氯酸稀释时pH 变化曲线
B. 取a 点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a 点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
难度: 困难查看答案及解析
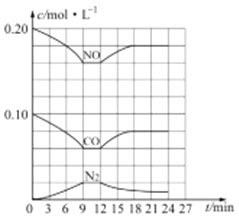
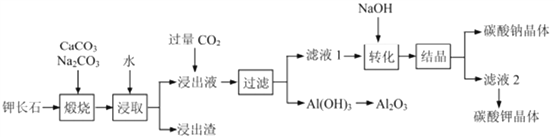

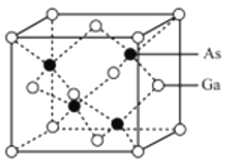
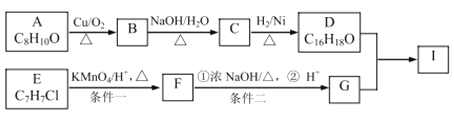
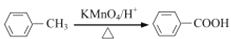

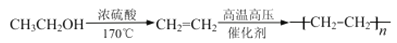 。
。