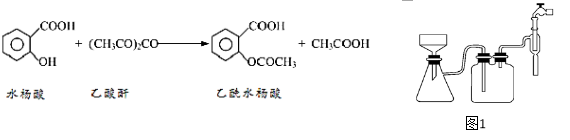-
钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:
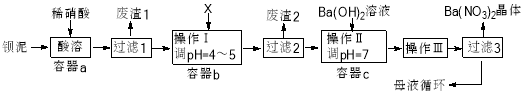
已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
-
在一个容积不变的密闭容器中,发生反应 :2NO(g)+O2(g)
:2NO(g)+O2(g) 2NO2(g)
2NO2(g)
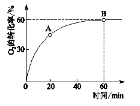
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆 (O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些
NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化
B.v正(NO)=2 v正(O2)
C.气体平均摩尔质量在此条件下达到最大
D.容器内气体密度不再变化
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g)△H= 。
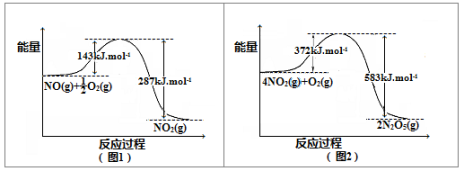
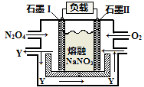
(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
-
阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】
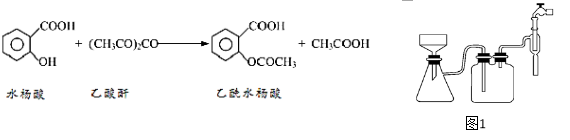
【实验流程】
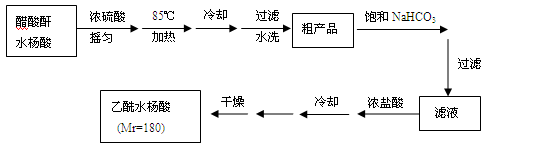
已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法______。
(2)用图1装置过滤比普通漏斗过滤的优点是______________________。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是_______;判断该过程结束的现象是___________。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是_____________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知 乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:
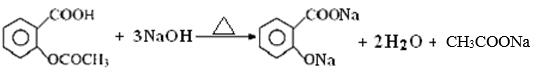
则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
-
分析下列水处理方法,完成下列问题:
(1)处理含Cr2O72-工业废水的工艺:
①工艺一:含Cr2O72-的工业废水 Cr3+、SO42-
Cr3+、SO42- 。
。
为了进一步除去上述流程中生成的Cr3+,请你设计一个处理方案:________________。
②工艺二:向废水中加入过量的FeSO4溶液,经过一系列反应后,FeSO4溶液和Cr2O72-可形成铁氧体沉淀,从而除去铬元素。若使含1mol Cr2O72-的废水中的Cr2O72-完全转化为一种化学式为Cr0.5Fe2.5O4的铁氧体(其中的铬元素为+3价),理论上需要绿矾(FeSO4·7H2O)的质量不少于______g,上述得到的铁氧体中,Fe3+和Fe2+的个数之比_____。
(2)如下是处理含氰(主要以CN—形式存在)废水工艺流程的一部分:含氰废水
 。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为—1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
。发生上述转化后CN—中碳元素转化为+4价,氮元素转化为0价,氯元素转化为—1价,若废水中CN—的浓度为300mg/L,含氰废水的流量为0.8m3/h,为保证安全,实际投放的ClO2为理论值得1.3倍,则为了完成上述过程每小时实际应该投入的ClO2的质量为__________kg(结果保留两位有效数字)。
(3)监测水中氯化物含量可采用硝酸汞滴定法,酸化的水样用硝酸汞滴定时可生成难电离的氯化汞,滴定到终点时过量的汞离子可与指示剂作用使溶液显示紫色。饮用水中的其他物质在通常浓度下对滴定不产生干扰,但水的色质、高价铁、六价铬、硫化物(如S2-)对实验有干扰。
①滴定前常用氢氧化铝悬浊液处理水样,其目的是__________________。
②若水中含有Cr2O72—,常在滴定前向水样中加入一定量的对苯二酚,其目的是______。
-
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式______,它位于周期表______区。
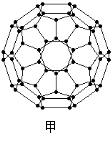
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为_______;1 mol C60分子中σ键的数目为_____个。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As____Ga(填“>”、“<”或“=”)。
②SeO2分子的空间构型为________。
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4 NH3 Cu NF3+3 NH4F,该反应中NH3的沸点 (填“>”、“<”或“=”)HF的沸点,NH4F固体属于 晶体。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________ _______ 。图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。

-
盐酸多利卡因是一种局麻药及抗心律失常药,可由芳香烃A为起始原料合成:
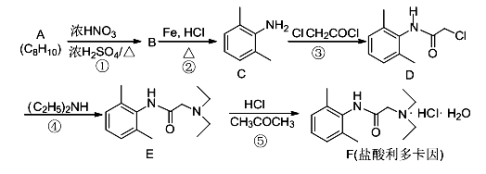

回答下列问题:
(1)B的官能团名称为____________,D的分子式为____________。
(2)反应①的化学方程式为_______________________,反应类型为____________,上述流程中,反应类型与①相同的还有____________(填反应序号)。
(3)反应④除了生成E外,另一种产物的化学式为____________。
(4)写出ClCH2COCl 与足量的NaOH溶液反应的化学方程式_______________________。
已知: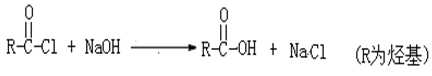
(5)C的芳香族同分异构体中,苯环上只有一个取代基的异构体共有________种(不考虑立体异构),其中核磁共振氢谱共有四个峰,且峰面积比为6:2:2:1的是______(写结构简式)。
电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
B.气态氢化物的稳定性:X<Z
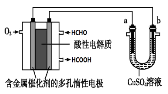
2H2SO4+2Cu+O2↑




 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。