-
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
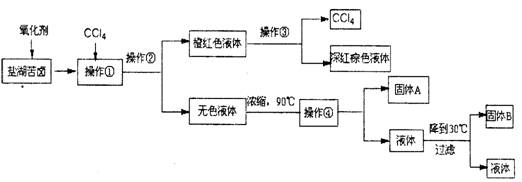
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是________。
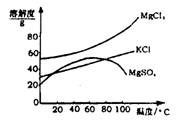
(2)参照右图溶解度曲线,得到的固体A的主要成分是(填化学式)。
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
【设计除杂过程】
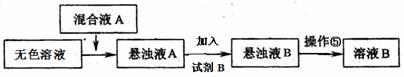
① 已知试剂B是K2CO3溶液,则混合液A的主要成分是(填化学式)。
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是。
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到时(填现象),停止加热。
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为。
-
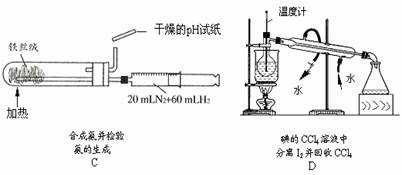
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
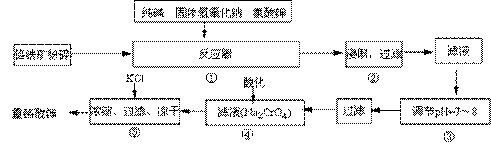
试回答下列问题:
⑴ 反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:。
⑵ NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:。
⑶ 作③的目的是什么,用简要的文字说明:。
⑷操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:。
⑸称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
② 断达到滴定终点的现象是;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品的中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)。
-
常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40 mL,溶液的pH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如右下图所示:
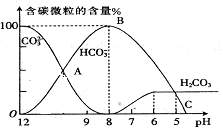 回答下列问题:
回答下列问题:
(1)在同一溶液中,H2CO3、HCO3-、 CO32- ________(填:“能”或“不能”)大量共存。
(2)当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:_________________。
 (3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_ _ ___。
(4)若将0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合,则混合后的溶液中c(CO32-) c(HCO3-)((填“大于”、“小于”或“等于”)。溶液中c(OH-)—c(H+)=[用 c(HCO3-)、 c(H2CO3)、c(CO32- )的关系式表示]
-
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如右图所示。
①合成氨条件选定的主要原因是(选填字母序号);
A.温度、压强对化学反应速率及化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
②改变反应条件,平衡会发生移动。压强增大,平衡常数K(填“增大”“减小”“不变”)
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式;
②在标准状况下,每生成1 mol B,转移电子的数目为。
(3) 最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式。
-
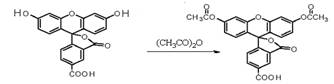
甲氧普胺(Metoclopramide)是一种消化系统促动力药。它的工业合成路线如下[已知氨基(-NH2)易被氧化剂氧化]:
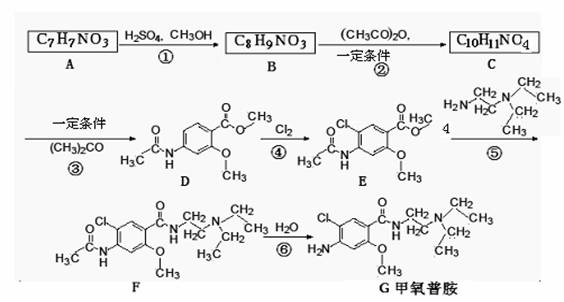
请回答下列问题:
(1)已知A物质既能与酸反应又能与碱反应,长期暴露在空气中会变质。 A物质中所含有的官能团除羧基外还有、。
(2)反应④的反应类型为
(3)反应③的另一种有机产物与新制Cu(OH)2悬浊液反应的化学方程式为。
(4)A物质的一种同分异构体H可以发生分子间缩合反应,形成一个含八元环的物质I,则I的结构简式为;
(5)写出以甲苯为原料合成 ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件。(有机物写结构简式,其它原料自选)
已知:Ⅰ、当一取代苯进行取代反应时,新引进的取代基因受原取代基的影响而取代邻、对位或间位。使新取代基进入它的邻、对位的取代基:-CH3、-NH2
使新取代基进入它的间位的取代基:-COOH、-NO2;
Ⅱ、-NH2易被氧化;-NO2可被Fe和HCl还原成-NH2
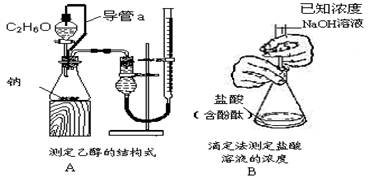
例:由乙醇合成聚乙烯的反应流程图可表示为
CH3CH2OH浓硫酸170℃CH2=CH2高温、高压催化剂 CH2-CH2
CH2-CH2 ________。
________。
-
 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 molNH3,反应达平衡后测得平衡常数为K,此时CH4的转化率为a。则K和a的关系是K=。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
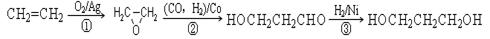
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
-
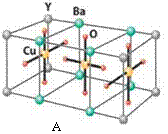 HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)写出基态Cu原子的核外电子排布。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的
键比键稳定(填“ ”或“
”或“ ”)。
”)。
(3)元素N、S、P的第一电离能(I1)由大到小的顺序为。
(4)与N3-互为等电子体的分子的化学式为(写1种)。
(5)CuCl2-中的化学键型为,超导氧化物A的化学式为。




 回答下列问题:
回答下列问题: (3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=
(3)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh==2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=
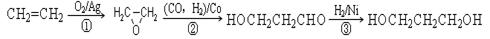
 HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题: