-
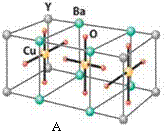 HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
(1)写出基态Cu原子的核外电子排布。
(2)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1。计算说明N2中的
键比键稳定(填“ ”或“
”或“ ”)。
”)。
(3)元素N、S、P的第一电离能(I1)由大到小的顺序为。
(4)与N3-互为等电子体的分子的化学式为(写1种)。
(5)CuCl2-中的化学键型为,超导氧化物A的化学式为。
-
下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水, 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
-
下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水, 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
-
无水叠氮酸(HN3)是无色易挥发、易爆炸的油状液体,沸点308.8K,其水溶液较稳定,用于有机合成、制造雷管等。制备原理:N2H4+HNO2=HN3+2H2O。则下列说法正确的是
A. HN3分子间存在氢键,故其沸点较高,化学性质较稳定
B. 上述反应中的氧化剂是HNO2
C. N2H4为分子晶体,HN3为离子晶体
D. 上述反应中每生成1mol HN3,转移电子8/3mol
-
我国钛资源丰富,攀枝花和西昌已探明钛矿储量就有几十亿吨,其重要的矿石有金红石 、钛铁矿
、钛铁矿 以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.
以及钒钛铁矿.如图1所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率.

 常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出
常温下为无色液体,具有刺激性气味,极易水解,其化学键类型为 ______ ,写出 水解的方程式 ______
水解的方程式 ______
 写出钛铁矿与焦炭、
写出钛铁矿与焦炭、 共热得到
共热得到 的化学方程式: ______
的化学方程式: ______
 ①
① 
②
请写出上图中 生成Ti的热化学反应方程式: ______
生成Ti的热化学反应方程式: ______
 海绵钛可用碘提纯,原理为
海绵钛可用碘提纯,原理为
 下列说法正确的是 ______
下列说法正确的是 ______
A 该反应正反应的
B 在不同温度区域, 的量保持不变
的量保持不变
C 在提纯过程中, 的作用是将粗钛从低温区转移到高温区
的作用是将粗钛从低温区转移到高温区
D 在提纯过程中, 可循环利用
可循环利用
 钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
钛网做阳极电解饱和食盐水常用隔膜电解槽.图2为阳离子交换膜电解槽示意图.
①该电解装置阳极在 ______  填左室、右室
填左室、右室 氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
氯碱工业电解槽一般采用Ti网作阳极而不用Fe网,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
 在上述产业链中合成112t甲醇理论上能生产Ti ______
在上述产业链中合成112t甲醇理论上能生产Ti ______  不考虑生产过程中物质的任何损失
不考虑生产过程中物质的任何损失
-
(15分)
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
-
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂.纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同.现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶.
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):______
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:______.
-
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
-
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
-
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)写出下列溶液中溶质的化学式
A___________,C_______________,E______________,F_________________。
(2)E的浓溶液与Cu应的化学方程式是______________________________________________________;该反应中氧化剂与还原剂的物质的量之比为____________;该反应的还原产物与少量B溶液反应的离子方程式是_____________________________________________________________________________。
(3)如何通过实验进一步确定D溶液的溶质?写出简要的操作及现象_____________________________。
 HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2 的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:”或“
”)。
