-
下列表示式错误的是( )
A. Na+的电子排布图:
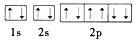
B. Na+的结构示意图:
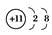
C. Na的电子排布式: 1s22s22p63s1
D. Na的简化电子排布式:[Ne]3s1
难度: 中等查看答案及解析
-
键线式可以简明扼要的表示碳氢化合物,
种键线式物质是( )
A.丁烯 B.丙烷 C.丁烷 D.丙烯
难度: 简单查看答案及解析
-
下列各组物质中,属于同分异构体的是 ( )
A.O2和O3
B.CH2=CHCH3和CH3CH=CHCH3
C.CH3CH2CH3和CH3(CH2)2CH3
D.CH3CH2OH和CH3OCH3
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是 ( )
A. C元素的最高正价为+7价
B. 原子半径:A>B>C
C. 离子半径:A2->C->B2+
D. 还原性:A2-<C-
难度: 中等查看答案及解析
-
下列原子的价电子构型中,第一电离能最小的是 ( )
A. 2s22p4 B. 3s23p4 C. 4s24p4 D. 5s25p4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH是三角锥形
难度: 简单查看答案及解析
-
0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能是 ( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl2]Cl·2H2O
D.[Cr(H2O)3Cl3]·3H2O
难度: 中等查看答案及解析
-
解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
①HF、HCl、HBr、HI的热稳定性依次减弱
②NH3易液化
③F2、Cl2、Br2、I2的熔、沸点逐渐升高
④H2S的熔、沸点小于H2O的熔、沸点
⑤NaF、NaCl、NaBr、NaI的熔点依次减低
A.①③④ B.③④ C.②③④ D.全部
难度: 中等查看答案及解析
-
CH3CH(C2H5)CH(CH3)2的名称是( )
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷
C.2,3-二甲基戊烷 D.3,4-二甲基戊烷
难度: 中等查看答案及解析
-
下列化学用语正确的是 ( )
A.乙醇的结构简式:C2H6O
B.HF的电子式:
C.Mg2+的核外电子排布式:1s22s22p6
D.N2的结构简式:∶N≡N∶
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
A. 质子数:c>b
B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ
D. 原子半径: X<W
难度: 简单查看答案及解析
-
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是 ( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
难度: 中等查看答案及解析
-
下列递变情况中,不正确的是 ( )
A. Na、Mg、Al原子的最外层电子数依次增多
B. Si、P、S元素的最高正价依次升高
C. C、N、O的原子半径依次增大
D. Li、Na、K的金属性依次增强
难度: 简单查看答案及解析
-
下列化合物的核磁共振氢谱中出现三组峰的是( )
A. 2,2,3,3四甲基丁烷
B. 2,3,4三甲基戊烷
C. 3,4二甲基己烷
D. 2,5二甲基己烷
难度: 简单查看答案及解析
-
下列变化过程中,没有破坏化学键的是 ( )
A.氧气溶于水 B.碳的燃烧
C.氯气与氢气反应 D.水的通电分解
难度: 简单查看答案及解析
-
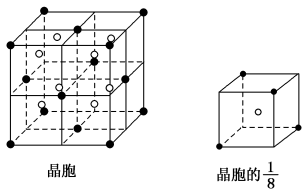
某物质的晶体中,含
三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出)。晶体中的A、B、C的原子个数比依次为 ( )
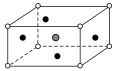
A.2:3:1
B.1:3:1
C.2:2:1
D.1:3:3
难度: 中等查看答案及解析
-
直接由原子构成的一组物质是( )
A.干冰、二氧化硅、金刚石
B.二氧化硅、金刚石、晶体硼
C.碘、石墨、氯化钠
D.氧化钠、金刚石、氯化氢
难度: 简单查看答案及解析
-
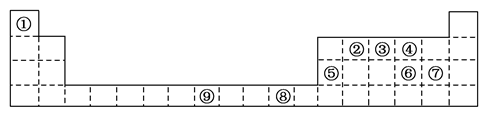
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是 ( )
A. 最高价氧化物对应水化物的酸性W比Z强
B. X的最常见气态氢化物的水溶液显酸性
C. Z的单质与氢气反应较Y剧烈
D. X的原子半径小于Y
难度: 中等查看答案及解析
-
下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al
A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A.Na2O和SiO2熔化
B.碘和干冰升华
C.氯化钠和蔗糖熔化
D.Mg和S熔化
难度: 简单查看答案及解析