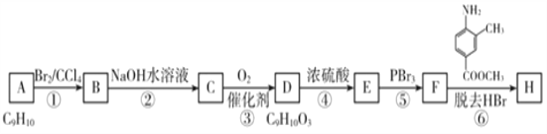
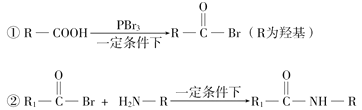
-
硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
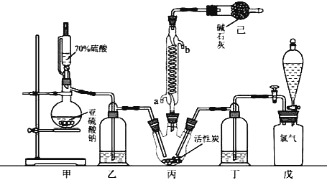
回答下列问题:
(1)装置己的作用是_________________________________________________;如何控制两种反应物体积相等:__________________________________________________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_____(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 mol·L−1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫会发生副反应,化学方程式是________________________________________________________;同时生成的SO2Cl2也会水解而“发烟”,该反应的化学方程式为______________________________________
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)______。
①控制气流速率,宜慢不宜快 ②持续加热丙装置
③若丙装置发烫,可适当降温 ④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是__________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
请设计实验方案检验产物中存在硫酸(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、蒸馏水、石蕊试液)_______________________________________________________________________。
-
MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为__________________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
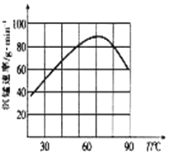
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是___________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为___________________。
-
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__而使Cu2O产率降低。
(2)已知:
①2Cu(s)+  O2(g)
O2(g) Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+  O2(g)
O2(g) CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+ O2(g)
O2(g) CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
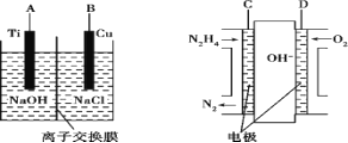
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g)  2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
| 序号 | 温度/℃c/mol·L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
| ② | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
| ③ | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
①催化剂的催化效率:实验①_______实验②(填“>”或“<”)。
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为________。
-
铜、铁、硒、钴、磷及其化合物在工业上有重要用途,回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________(用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,Na3[Co(NO2)6]中存在的化学键有__________。
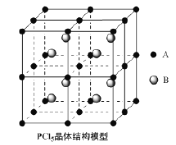
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如下左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为______,其中心原子杂化轨道类型为__________,B为________。
(5)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。

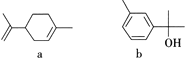 只能用金属钠鉴别a和b
只能用金属钠鉴别a和b
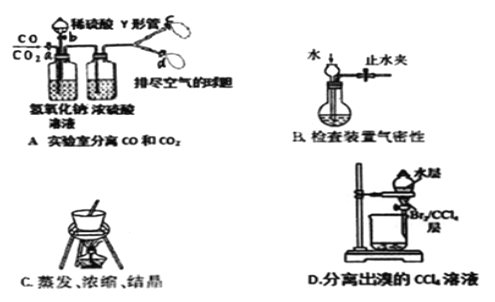
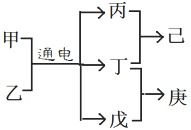
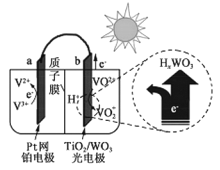
,下列分析不正确的是

c(Cl-)+c(ROH)+c(OH-)=c(H+)