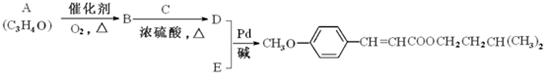
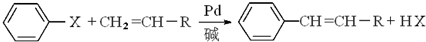-
元素的原子结构决定其性质和周期表中的位置.下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子的能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素难度: 中等查看答案及解析
-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定难度: 中等查看答案及解析
-
化学与生产、生活密切相关.下列叙述正确的是( )
A.煤的干馏与石油的分馏均属于化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.14C可用于文物的年代鉴定,14C与13C互为同素异形体
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al难度: 中等查看答案及解析
-
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7难度: 中等查看答案及解析
-
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程
B.因部分电能转化为热能,电镀是通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用难度: 中等查看答案及解析