-
美国UIC大学两位国家级传染病学专家认为,当前形势的埃博拉病毒已经能够通过气溶胶传播。据此,下列说法正确的是
A、埃博拉病毒无法通过呼吸传播
B、佩戴口罩可有效预防埃博拉病毒侵染
C、目前已找到有效治疗埃博拉病毒的方法
D、埃博拉病毒颗粒直径大约80nm
难度: 中等查看答案及解析
-
下列物质与其用途完全符合的有几条
①Na2CO3-制玻璃 ②SiO2-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤Al2O3-焊接钢轨 ⑥NaClO-消毒剂
⑦MgO-耐火材料 ⑧Fe2O3-红色油漆或涂料
A、4 B、5 C、6 D、7
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说正确的是
A、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B、室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA
C、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D、5NH4NO3 = 2HNO3 + 4N2↑ + 9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I- = 2Fe2+ + I2
B、氧化铝溶解在NaOH溶液中:3H2O + Al2O3 + 2OH-= 2[Al(OH)4]-
C、硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全Al3+ + SO42-+ Ba2+ + 3OH- = BaSO4 ↓ + Al(OH)3↓
D、在漂白粉配制成的溶液中通入SO2:Ca2+ + 2ClO- + SO2 + H2O = CaSO3↓+ 2HClO
难度: 困难查看答案及解析
-
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法错误的是
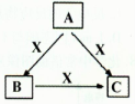
A、若X为Cl2,则C可能为FeCl3
B、若X为KOH溶液,则A可能为AlCl3
C、若X为O2,则A可为硫化氢
D、若A、B、C均为焰色反应呈黄色的物质,则X可能为O2
难度: 中等查看答案及解析
-
某无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:
⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
⑵在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
⑶在⑵所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时析出白色沉淀乙。
则下列离子在原溶液中一定存在的有2
A、SO42-、AlO2─、Na+、CO32─ B、Na+、CO32─、AlO2─
C、CO32─、Na+、Al3+ D、MnO4─、Na+、CO32─
难度: 困难查看答案及解析
-
可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸
②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铁和铜反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
A、①②④ B、②④ C、②③④ D、①②③④
难度: 中等查看答案及解析
-
将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
A、4 B、6 C、8 D、16
难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L。下列叙述中正确的是
①ω=
②C=
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为: c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A、①④ B、②③ C、①③ D、②④
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.Y的气态简单氢化物的热稳定性比W的强
B.X的最高价氧化物对应水化物的酸性比W的弱
C.Y分别与Z、W形成的化合物均为碱性氧化物
D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
难度: 中等查看答案及解析
-
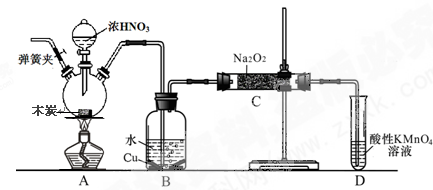
利用图中所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论

A
浓盐酸
MnO2
NaOH
制氯气并吸收尾气
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
难度: 中等查看答案及解析
-
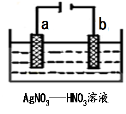
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是

A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体
难度: 中等查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是

A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓
B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.d点溶液中含有的溶质只有NaAlO2
难度: 困难查看答案及解析
-
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为
A.3:2 B.4:5 C.2:3 D.3:4
难度: 中等查看答案及解析
-
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
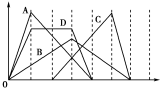
A、向NaAlO2溶液中滴入盐酸至过量
B、向澄清石灰水中通入CO2至过量
C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A、取ag混合物充分加热,剩余bg固体
B、取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg
C、取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体
D、取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体
难度: 中等查看答案及解析
-
已知:(1)C(s)+O2(g)=CO2(g) △H1
(2)CO2(g)+C(s)=2CO(g) △H2
(3)2CO(g)+O2(g)=2CO2(g) △H3
(4)4Fe(s)+3O2(g)=2Fe2O3(s) △H4
(5)3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A、△H1=△H2+△H3 B、△H2>0,△H4>0
C、△H1>0,△H3<0 D、△H3=△H4+△H5
难度: 中等查看答案及解析
-
某含Cr2O72-废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeO•FeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
A、消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B、处理废水中Cr2O72-的物质的量为(nx/2)mol
C、反应中发生转移的电子的物质的量为6nxmol
D、在FeO•FeyCrxO3中3x=y
难度: 中等查看答案及解析