-
垃圾分类从你我他开始。废电池属于

A. B. C. D.
难度: 简单查看答案及解析
-
化学美无处不在,下图是物质间发生化学反应的颜色变化,其中X是
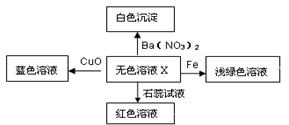
A.稀盐酸 B.稀硫酸 C.硫酸钠溶液 D.碳酸钠溶液
难度: 中等查看答案及解析
-
下列说法不正确的是
A.分子式为C5H10O2的羧酸共有3种
B.分子式为C3H9N的异构体共有4个
C.某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1
D.某烷烃CnH2n+2的一个分子中,含有非极性键的数目是n-1
难度: 中等查看答案及解析
-
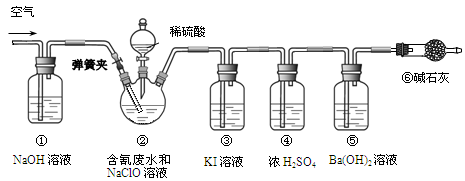
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
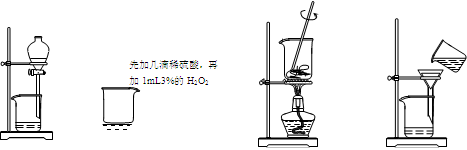
A.放出碘的苯溶液 B.氧化I- C.将海带灼烧 D.过滤含I-溶液
难度: 中等查看答案及解析
-
“酸化”是实验中经常采用的方法,下列酸化过程正确的是
A.抑制Fe2+的水解,用稀硝酸酸化
B.提高高锰酸钾的氧化能力,用盐酸酸化
C.确认溶液中含有
时,先用盐酸酸化,再检验
D.检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验
难度: 中等查看答案及解析
-
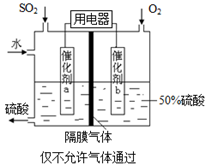
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、
、
、
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
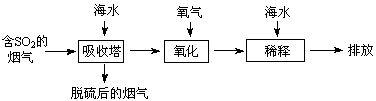
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含
、
B.吸收塔中发生的反应有SO2+H2O
H2SO3
C.氧化主要是氧气将
、
、H2SO3氧化为
D.经稀释“排放”出的废水中,
浓度与海水相同
难度: 中等查看答案及解析
-
以下进行性质比较的实验,不合理的是
A.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中
B.比较氯、溴单质的氧化性:溴化钠溶液中通入氯气
C.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液
D.比较碳、硫非金属性:测定同条件同物质的量浓度的Na2CO3、Na2SO4溶液的pH
难度: 中等查看答案及解析
-
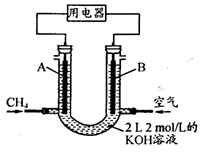
如图是某同学设计的原电池装置,下列叙述中正确的是
A.电极Ⅰ上发生还原反应,作原电池的负极
B.电极Ⅱ的电极反应式为: Cu2++2e-= Cu
C.该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
-
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如右图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是
甲
A.元素甲的简单气态氢化物稳定性比乙的强
B.元素乙在周期表中的位置为第2周期,VIA族
C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸
D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲
难度: 困难查看答案及解析
-
下列实验不是由浊液变清液(溶液)再变浊液的是
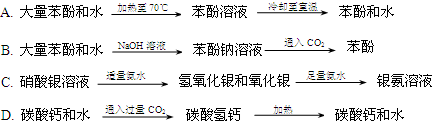
难度: 中等查看答案及解析
-
下列图像表达正确的是
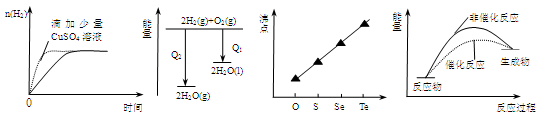
A.等质量锌粉与足量盐酸反应
B.氢气与氧气反应中的能量变化
C.气态氢化物沸点
D.催化反应与非催化反应过程中的能量关系
难度: 中等查看答案及解析
-
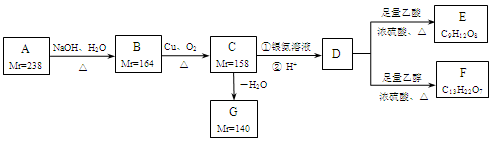
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是
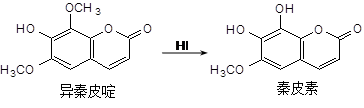
A.异秦皮啶与秦皮素互为同系物
B.异秦皮啶分子式为C11H12O5
C.秦皮素一定条件下能发生加成反应、消去反应和取代反应
D.1mol秦皮素最多可与2molBr2(浓溴水中的)、4molNaOH反应
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是
A.葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖)
6C+6H2O
B.向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S + 2Cl- = 2AgCl↓+ S2-
C.将NH3通入滴有酚酞的水中,溶液变红:NH3 + H2O
NH3·H2O
+ OH-
D.明矾的水溶液pH<7: Al3+ + 3H2O
Al(OH)3(胶体)+3H+
难度: 中等查看答案及解析
-
Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n(
): n(
)变化的关系如下表:
n(
): n(
)
91:9
1:1
9:91
pH
8.2
7.2
6.2
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+) < c (OH-)
B.Na2SO3溶液中c(Na+)> c (
)> c (
) > c (OH-) > c(H+)
C.当吸收液呈中性时,c(Na+) >c (
) > c (
) > c (OH-) = c(H+)
D.当吸收液呈中性时,c(Na+) >c (
) +c (
)
难度: 困难查看答案及解析