-
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
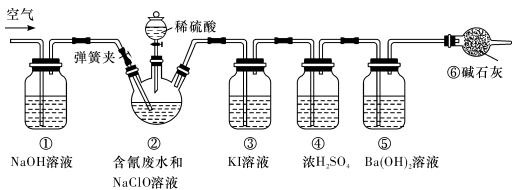
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。(保留一位小数)
-
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
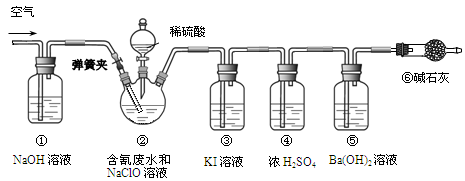
已知装置②中发生的主要反应依次为:CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是________。
(2)装置②中,生成需由装置③除去的物质的离子方程式为________。
(3)反应结束后,缓缓通入空气的目的是________。
(4)为计算该实验中含氰废水被处理的百分率,需要测定________的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为________。
-
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用下图所示装置进行实验。将CN-的浓度为0.2 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
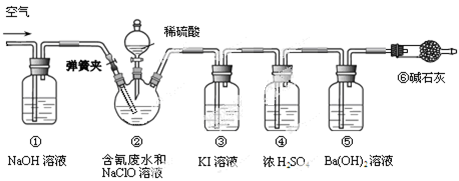
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ +3C1O-=N2↑+2CO2↑+3C1-+H2O
(1)①和⑥的作用是 。
(2)装置②中,生成需由装置③除去的物质的离子方程式为 。
(3)反应结束后,缓缓通入空气的目的是 。
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量。
(5)已知CN-的处理效率可高达90%,产生的CO2在标准状况下的体积为 。
-
某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):





某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
-
保护环境是全球关注的问题。
Ⅰ.某环保部门处理含CN-电镀废水的方法如图(CN-的CNO-中的N的化合价均为-3价):

某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。
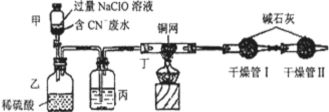
操作步骤:
i.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200mL混合液(其中c(CN-)为0.200mol·L-1)加到装置甲中,塞上橡皮塞。
ii.装置甲中,充分反应后,打开橡皮塞和开关,使溶液全部流入装置乙中,关闭开关。
iii.测定干燥管I增加的质量。
(1)写出装置乙中反应的离子方程式:________。
(2)装置丙中的试剂是________,装置丁的作用是________。
(3)假定上述实验中的气体都被充分吸收。若干燥管I增重1.408g。则CN-被处理的百分率为________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”)。简述你的理由:________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)科学研究表明,脱硫率与Fe3+浓度、pH关系如图1、2。
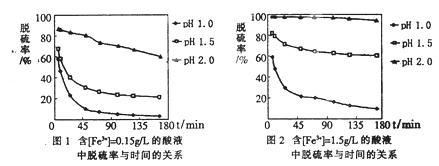
为达到最佳脱硫效果,应采取的适合[Fe3+]及pH分别是________、________。
(6)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液后,各取10mL反应液分别加到编号为A、B、C的试管中,并设计后续实验的3个方案:
方案①:A中加入少量KMnO4溶液,紫红色褪去。
方案②:B中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________。
-
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是
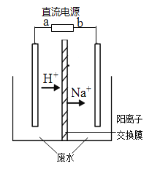
A. 直流电源a端连接的电极发生氧化反应
B. 若以氢氧燃料电池为直流电源,燃料电池的a极应通入H2
C. 反应进行一段时间,右侧电极附近酸性减弱
D. 电解过程中阳极区生成乙酸,阴极区生成乙醇
-
Ⅰ.含CN-电镀废水的一种方法如图(CN-和CNO-中N的化合价均为-3价)

某学习小组依据上述方法,用如图实验装置进行该电镀废水处理的研究。
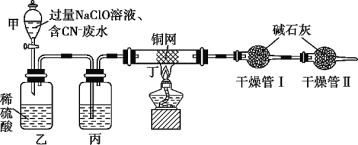
操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为________________;装置乙中反应的离子方程式为________________。
(2)装置丙中的试剂是________________,装置丁的作用是________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408g。则CN-被处理的百分率为________________。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会________________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________(填方案编号)。
-
工业上常用隔膜电解法将乙醛转化为乙醇和乙酸来处理高浓度乙醛废水。探究性学习小组用如图所示装置电解一定浓度的乙醛-Na2SO4溶液,模拟乙醛废水的处理过程。下列说法正确的是
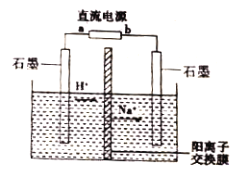
A. a 为直流电源的负极
B. 阳极的电极反应为:CH3CHO-2e-+H2O=CH3COOH+2H+
C. 电解过程中,阴极区的pH逐渐减小
D. 理论上阳极区处理废水的能力是阴极区的两倍
-
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:某实验兴趣小组通过下图装置,利用稀硫酸、KClO3和草酸溶液制备ClO2,并用它来处理含Mn2+的工业废水。
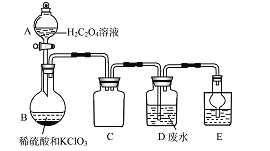
①A 装置的名称是______________,C装置的作用为__________________。
②B 中反应产物有ClO2、CO2等,请写出该反应的化学方程式:___________________。
③写出装置D中除去Mn2+的离子方程式__________________。 (已知Mn2+转化为MnO2)
(2)ClO2易溶于水。用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL 试样: 量取V1mL 试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI 晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol·L-1Na2SO3溶液滴定至终点,消耗Na2S2O3溶液V2mL。 (已知2Na2S2O3+I2=Na2S4O6+2NaI)
①滴定终点的判断依据是___________________。
②原ClO2溶液的浓度为_______________g/ L (用步骤中的字母代数式表示)。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果___________(填“偏高”、“ 偏低”或“无影响” )
-
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:某实验兴趣小组通过下图装置,利用稀硫酸、KClO3和草酸溶液制备ClO2,并用它来处理含Mn2+的工业废水。
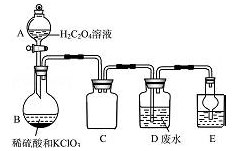
①A装置的名称是 ,C装置的作用为 .
②B中反应产物有ClO2、CO2等,请写出该反应的化学方程式: 。
③写出装置D中除去Mn2+的离子方程式 。(已知Mn2+转化为MnO2)
(2)ClO2易溶于水。用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知2 Na2S2O3 + I2 = Na2S4O6 + 2NaI)
①滴定终点的判断依据是 。
②原ClO2溶液的浓度为 g / L(用步骤中的字母代数式表示)。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果 (填“偏高”、“偏低”或“无影响”)












