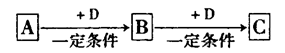-
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.
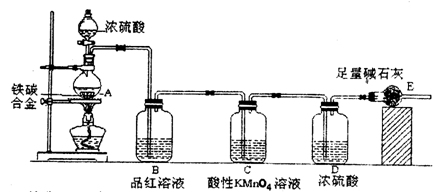
(1)m g铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因
是:①常温下碳与浓硫酸不反应;②_____________。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式____________。
(3)B中的现象是:____________;C的作用是:_______________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。则铁碳合金中铁的质量分数为_____________。
(5)甲同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:___________。
(6)最后对所得测量结果进行评价,小组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低的是(任答一条即可)
_____________。
-
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:
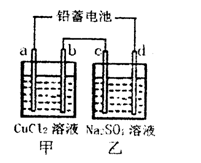
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
(填写序号)
A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s)+4H+(aq)+ (aq)+4e-
(aq)+4e- PbSO4(s)+2H2O(1)
PbSO4(s)+2H2O(1)
D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准
状况下)
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA- H++A2-,请回答下列问题:
H++A2-,请回答下列问题:
①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g) 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
-
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
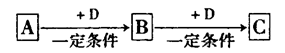
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学程式为______________。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为 ___________________.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)___________________。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为___________ (填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为____________________________.
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是_________________。
-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)

(1)A的简单氢化物分子中其中心原子采取________杂化,E的最高价氧化物分子的空间构型是____________。
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是_____________.
(3)A、B、C、D的第一电离能由小到大的顺序为
_________________。(用元素符号表示)
(4)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为____________;(每个球均表示1个原子)
(5)F的价电子轨道表示式是______________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______________________。
-
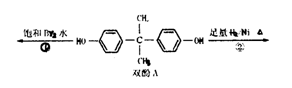
某芳香化合物H常用作食用香精。用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5 :5 :1。H只有一个支链;它能与溴的四氯化碳溶液发生加成反应。且在碱性条件下能发生水解反应,产物之一是甲醇。G是H的同分异构体。用芳香烃A为原料合成G的路线如下:
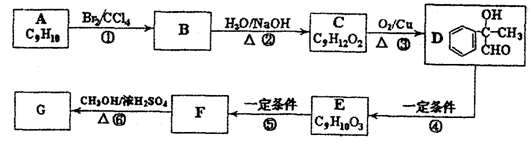
(1)G的分子式是____________,H的结构简式是_________________。
(2)化合物C的官能团名称是________________,反应②、⑤的反应类型分别是______________、______________。预测E分子中苯环侧链核磁共振氢谱峰面积(由小到大)之比为________________。
(3)写出反应①、⑥的化学方程式:
①___________________________________________________;
⑥___________________________________________________,
(4)符合下列条件的F的同分异构体的结构简式是_______________________。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。

(甲基碳正离子)含有的电子数目为9NA
CO2
白色沉淀,说明元素的非金属性:Cl>C>Si;⑨从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;⑩胶体和溶液的本质区别是分散剂微粒直径的不同。