-
化学在生产和生活中有重要的应用。下列说法正确的是
A.医用酒精的浓度通常为95%
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀
D.硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,17gND3中所含分子数目NA
B.25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA
C.用惰性电极电解CuSO4溶液后,如果加入0.lmolCu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA
D.6gSiO2所含分子数为0.1NA,化学键总数为0.4NA
难度: 中等查看答案及解析
-
酯类物质广泛存在于草莓、香蕉、梨等水果中,某同学从成熟的香蕉中分离出一种酯,然后将该酯在酸性条件下进行水解实验,得到分子式为C2H4O2和C4H10O的两种物质,下列有关的分析判断正确的是
A.C4H10O的同分异构体有很多种,其中属于醇类只有4种
B.水解得到的两种物质,C2H4O2可以与金属钠作用发出氢气,而C4H10O不可以
C.水解得到的物质C2H4O2和葡萄糖的最简式相同,所以二者的化学性质相似
D.该同学分离出的酯的化学式可表示为C6H14O2,它的同分异构体属于酯类的有10种
难度: 困难查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
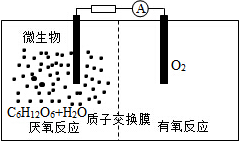
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
A.最高正化合价:X<Y<Z
B.原子半径:X<Y<Z
C.气态氢化物的热稳定性:Z<W
D.最高价氧化物对应水化物的酸性:X<Z
难度: 中等查看答案及解析
-
下列实验操作说法正确的是
选项
实验操作
现象与结论(或装置用途)
A
2mL2%CuSO4溶液中加4~6滴2%NaOH溶液,振荡后加入0.5mLX溶液,加热煮沸
未出现砖红色沉淀,说明X不含醛基
B

可以用于比较Fe3+、I2、Cl2的氧化性强弱
C
某溶液中加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸
试纸变蓝,说明NH3溶于水显碱性
D

用图示装置分离沸点相差较大的互溶液体混合物
难度: 中等查看答案及解析
-
常温下,用 0.1000mol•L-1NaOH溶液滴定 20.00mL0.1000mol•L-1CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
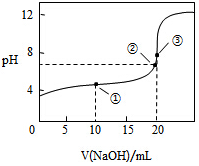
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 中等查看答案及解析

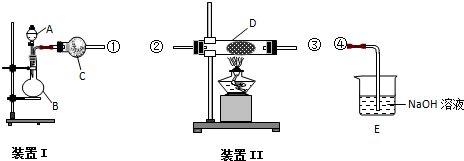

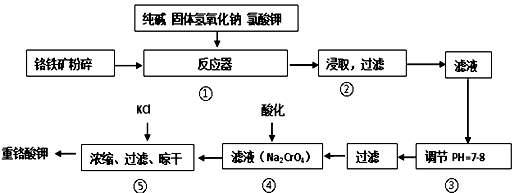
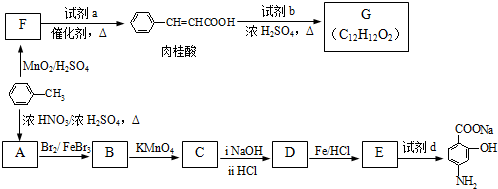
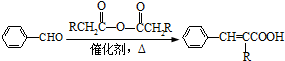 (R=-CH3或-H)
(R=-CH3或-H)