-
( 9分)重铬酸钾(K2Cr2O7)是重要氧化剂,重铬酸钾的溶解度受温度影响较大,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2•Al2O3)为原料生产它。实验室模拟工业上用铬铁矿制 K2CrO7的主要工艺流程如下图。涉及“碱熔”的主要反应为:
6 FeO•Cr2O3 + 24NaOH + 7KC1O3 = 12NaCrO4 + 3Fe2O3 + 7KCl + 12H2O
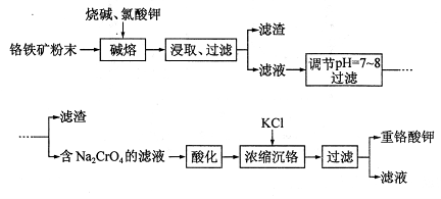
(1)使用粉末状铬铁矿的目的是 。
(2)调节pH后,过滤得到的滤渣是 (填化学式)。
(3)酸化Na2CrO4溶液时,其平衡转化的离子方程式为 。
(4)称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加入10 mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100 mL 水,加人3mL淀粉溶液(作指示剂),用0.1200 mol/LNa2S2O3标准溶液滴定( I2 + 2S2O2- 3= 2I-+S4O2- 6),用去20.00mL ,则该样品的纯度为 。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图。涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
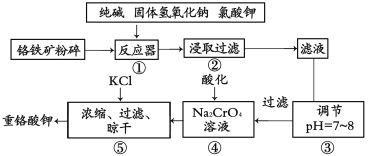
(1)碱浸前将铬铁矿粉碎的作用是_______________。
(2)步骤③调节pH后过滤得到的滤渣是____________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因____________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①滴定时淀粉的作用为_______,判断达到滴定终点的依据是_____________。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)_____________(保留2位有效数字)。
-
【化学—选修2:化学与技术】(15分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
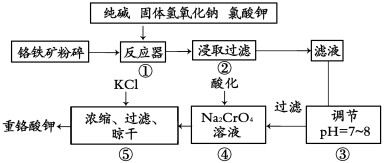
(1)碱浸前将铬铁矿粉碎的作用是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I一十S4O52-)
①判断达到滴定终点的依据是 。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
-
(14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
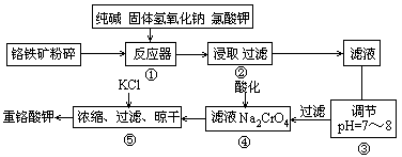
(1)碱浸前将铬铁矿粉碎作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
-
(14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
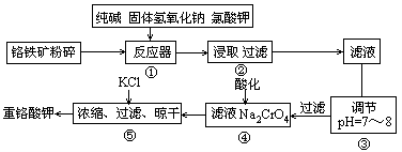
(1)碱浸前将铬铁矿粉碎的作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均不相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
-
(14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
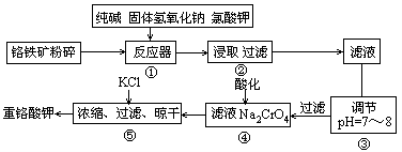
(1)碱浸前将铬铁矿粉碎的作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均不相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO•Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图.涉及的主要反应是:
6FeO•Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O.
12Na2CrO4+3Fe2O3+7KCl+12H2O.
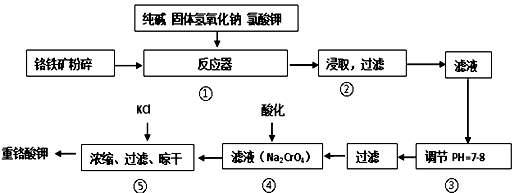
(1)碱浸前将铭铁矿粉碎的作用是________;
(2)步骤③调节pH后过滤得到的滤渣是________;
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________;
(4)用简要的文字说明操作⑤加入KCl的原因________;
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与腆量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是________;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)________(保留2位有效数字)
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料产它,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
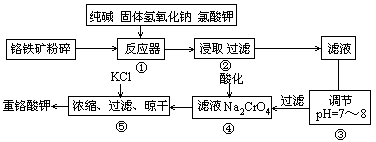
(1)碱浸前将铭铁矿粉碎的作用是________
(2)步骤③调节pH后过滤得到的滤渣是________。
(3)操作④中,酸化时,CrO2- 4转化为Cr2O2- 7,写出平衡转化的离子方程式
;
(4)用简要的文字说明操作⑤加入KCl的原因________。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判断达到滴定终点的依据是________;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应)(保留2位有效数字)。
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实数室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。
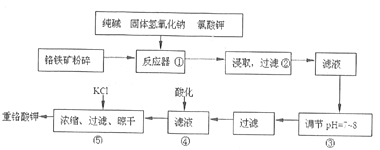
涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)进入反应器①之前将铬铁矿粉碎的目的是____________________________。
(2)步骤②过滤得到的滤渣主要成分是_______________。过滤所需的玻璃仪器有_________________。
(3)操作④中酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________________。
(4)操作③调节溶液pH=7~8的目的是_________________________。
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72-的废水,原理示意图如下图。
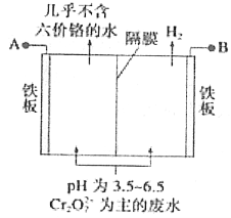
B为电解池的________极,写出阳极的电极反应式____________________。阳极区域溶液中发生反应的离子方程式为____________________________________。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,则溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
-
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O。

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:______________、________________。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,写出该反应的化学方程式: 。
简述检验溶液中是否存在Fe3 +的方法是: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(5)铬(Cr)与铝的性质相似,试写出Cr(OH)3 溶于NaOH 溶液所发生反应的离子反应方程式: 。
12Na2CrO4+3Fe2O3+7KCl+12H2O.










