-
下列说法正确的是 ( )
A.任何化学反应都伴随着能量的变化
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.化学反应中的能量变化都是以热量的形式体现
D.2CO(g)+O2(g)=2CO2(g) △H<0,则56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
难度: 简单查看答案及解析
-
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是 ( )
A. ①③②④ B. ③④②① C.①③④② D.③①②④
难度: 中等查看答案及解析
-
若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜上发生的反应是:Ag++e- = Ag
④在银片上发生的反应是:4OH—-4e— = O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
难度: 中等查看答案及解析
-
CO(g)+H2O(g)
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是( )
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
难度: 中等查看答案及解析
-
金属镍有广泛的用途粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e—
Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 中等查看答案及解析
-
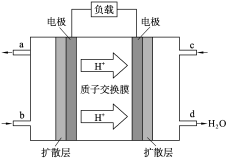
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )

A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
难度: 困难查看答案及解析
-
一定条件下可逆反应:2NO2(g)
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
由金红石TiO2制取单质Ti,涉及到的步骤为:TiO2
TiCl4
Ti
已知:① Cs+O2g=CO2g; H1
② 2COg+O2g=2CO2g; H2
③ TiO2s+2Cl2g=TiCl4s+O2g; H3
则反应 TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H为( )
A. H3 + 2H1 -2H2 B. H3 + H1 -H2
C. H3 +2H1 -H2 D. H3 + H1 - 2H2
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g) +2CO(g)
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其它条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其它条件不变,使用不同催化剂,该反应的平衡常数不变
难度: 中等查看答案及解析
-
下图所示装置中,已知电子由b极沿导线流向锌。下列判断正确的是 ( )
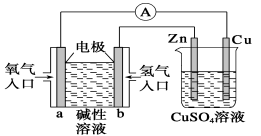
A.该装置中Cu极为阳极
B.一段时间后锌片质量减少
C.b极反应的电极反应式为H2-2e-+2OH-===2H2O
D.当铜极的质量变化为32 g时,a极上消耗的O2的体积为5.6 L
难度: 中等查看答案及解析
-
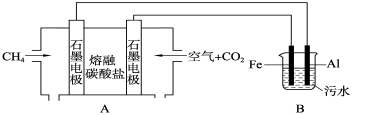
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知。通入CH4的一极,其电极反应式是:CH4 + 10OH――8e-==CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O + 8e-== 8OH-下列叙述正确的( )
A.通入CH4的电极为负极
B.负极发生氧化反应
C.该电池使用一段时间后无需补充KOH
D.燃料电池工作时,溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
二氧化硫的催化氧化原理为
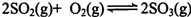 ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )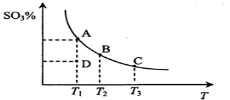
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g)
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是 ( )
A.放电时负极反应为:Zn-2e+2OH =Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
难度: 中等查看答案及解析
-
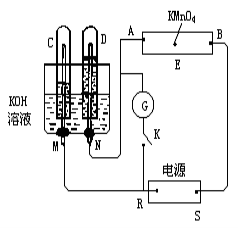
有关右图装置的叙述中,正确的是( )
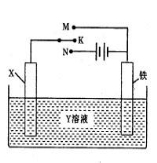
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动
难度: 中等查看答案及解析
-
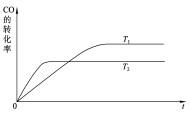
同压、不同温度下的反应:A(g)+B(g)
C(g) △H ,A的含量和温度的关系如图3所示,下列结论正确的是( )
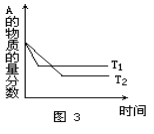
A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0
难度: 中等查看答案及解析
-
在一密闭容器,aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a > b
难度: 中等查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的是 ( )
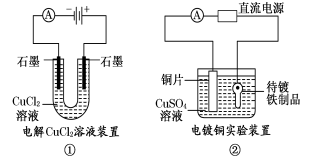

A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源负极相连
C.装置③中外电路电子由a极流向b极
D.装置④的阳极反应为:2H+ + 2e— = H2↑
难度: 中等查看答案及解析