-
一氧化碳和二氧化硫是用途广泛的化工基础原料。
(1)已知:C(s)+O2(g)=CO2(g) △H1=– 393.5 kJ·mol – 1
C(s)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol – 1
S(s)+O2(g)=SO2(g) △H3=– 296.0 kJ·mol – 1
已知某反应的平衡常数 ,据以上信息,请写出该反应的热化学反应方程式: 。
,据以上信息,请写出该反应的热化学反应方程式: 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
(3)工业利用反应2SO2(g)+O2(g)  2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体密度保持不变
c.SO2和O2的物质的量之比保持不变
d.每消耗1 mol SO3的同时,生成0.5 mol O2
(4)下图中A装置为熔融盐燃料电池的工作原理示意图。某课外活动小组用下图所示装置通过电解生成Fe(OH)3进行水的净化。
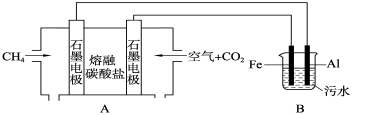
①已知该燃料电池负极的电极反应是CH4+4CO32--8e- = 5CO2+2H2O。
则正极的电极反应式是 。
电解池B阳极的电极反应式为 。
②实验过程中,若在阴极产生了22.4 L(标准状况)气体,则熔融盐燃料电池消耗CH4 L(标准状况)。
-
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)
2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:
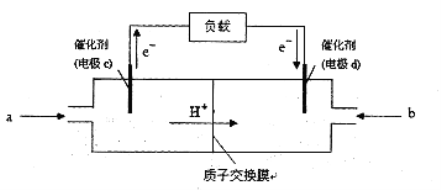
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
(16分)一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;
2CO2(g) △H1=-566.0kJ·mol-1;
S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
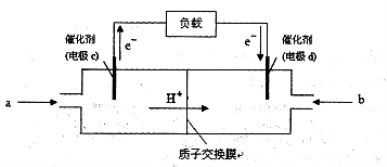
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的____极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知; CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
CH3OH(l)+H2O(l) △H=-131.0kJ/mol;
H2(g)+  O2(g)= H2O(l) △H=-285.8 kJ/mol。
O2(g)= H2O(l) △H=-285.8 kJ/mol。
CH3OH的燃烧热△H=_______。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:
CO2(g)+CH4(g) CH3COOH(g) △H=+36.0 kJ/mol
CH3COOH(g) △H=+36.0 kJ/mol
在不同温度下乙酸的生成速率变化如右图所示。

①当温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是______,当温度在300℃~400℃范围时,影响乙酸生成速率的主要因素是________。
②欲使乙酸的平衡产率提高,应采取的措施是________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应: C(s)+CO2(g) 2CO(g)。
2CO(g)。
①向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如右图所示。则该反应为_____(填“放热”或“吸热”)反应,某温度下,若向该平衡体系中再通入0.2molCO2,平衡____(填“正向”“逆向”“不”)移动,达到新平衡后,体系中CO的百分含量________ (填“变大”“变小”“不变”)。
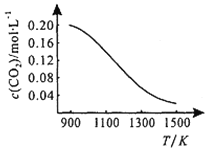
②向压强为p体积可变的恒压容器中充入一定量CO2,650℃时反应达平衡,CO的体积分数为40.0%,则CO2的转化率为_________。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=_________(用含p的代数式表示),若向平衡体系中再充入V(CO2): V(CO)=5:4的混合气体,平衡______(填“正向”“逆向”“不”)移动。
-
(16分)一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。
已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566.0kJ/mol
②S(s)+ O2(g)=SO2(g)ΔH=-296.0kJ/mol
请写出CO还原SO2的热化学方程式______ 。
(2)工业土用一氧化碳制取氢气的反应为:CO(g)+H2O(g)  CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
CO2(g) +H2(g)。已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为_________,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为___________反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
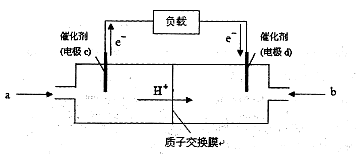
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的___________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
-
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1= —393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2= —483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g) +O2(g)=== H2O(g)+CO2(g)的△H=________kJ·mol-1 。
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移______mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为________;
则该电池的正极反应式是________。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
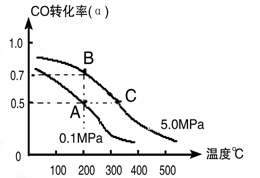
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是________。
-
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g) +O2(g)=== H2O(g)+CO2(g)的△H=。
标准状况下的煤炭气(CO、H2)336L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-===3CO2+H2O;则该电池的正极反应式是:________。
(3)密闭容器中充有1 mol CO与2mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
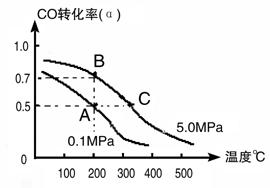
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tC ________ tA(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是________。(写出两点即可)
-
(14分)CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则反应CO(g)+H2(g) +O2(g)=== H2O(g)+CO2(g)的△H=kJ·mol-1 。标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移________mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-→3CO2+H2O;则该电池的正极反应式是:________。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
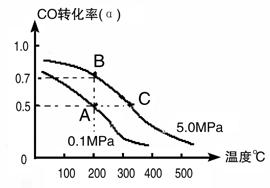
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是________。
-
CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:C(s)+O2 (g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1
C(s)+H2O(g)═CO(g)+H2(g)△H3=+131.3kJ•mol-1
则反应CO(g)+H2(g)+O2(g)═H2O(g)+CO2(g)的△H=______kJ•mol-1.
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移______mol电子.
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的.负极的电极反应式为______;则该电池的正极反应式是______.
(3)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.
CH3OH(g);CO的转化率(α)与温度、压强的关系如图所示.

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=______;此时在B点时容器的体积VB______10L(填“大于”、“小于”或“等于”).
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______.
-
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。 Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
下列说法正确的是
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
,据以上信息,请写出该反应的热化学反应方程式: 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为 ,H2的化学反应速率为 。
2SO3(g)制硫酸,一定条件下,将1molSO2与2molO2置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是









