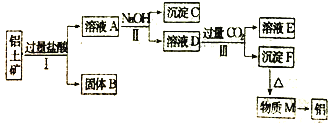
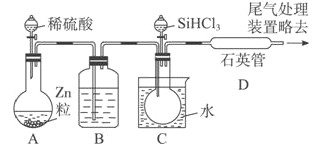
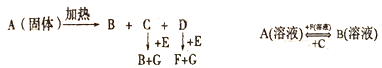-
下列混合物分离(或除杂) 的方法正确的是( )
A. 除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤
B. 除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C. 除去NaHCO3溶液中的Na2CO3:加适量稀盐酸
D. 除去Al203中的少量Fe2O3:加入过量氢氧化钠溶液,过滤、洗涤
难度: 中等查看答案及解析
-
要使氯化铝溶液中的Al3+完全转化为Al(OH)3沉淀,应选用的最佳试剂是
A. NaOH溶液 B. 稀盐酸 C. 氨水 D. AgNO3溶液
难度: 中等查看答案及解析
-
下列关于金属的叙述中正确的是( )
A. 常温下所有的金属都是固态 B. 金属具有导电、导热和延展性
C. 地壳中含量最多的金属铁元素 D. 金属元素大多数以游离态存在于自然界
难度: 中等查看答案及解析
-
Al2O3常用于制造耐火坩埚,但氧化铝坩埚不能用于加热熔融下列化合物中的( )
A.NaCl B.NaNO3 C.NaOH D.Na2SO4
难度: 简单查看答案及解析
-
苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使Fe2+转变为Fe3+离子。若榨苹果汁时加入维生素C,会有效防止这种现象的发生。这说明维生素C具有
A. 氧化性 B. 还原性 C. 酸性 D. 碱性
难度: 简单查看答案及解析
-
一块表面已被氧化为Na2O的钠块17.0g,将其投入100水中,产生H20.2g,则被氧化的钠是( )
A. 4.6g B. 12.4g C. 6.2g D. 9.2g
难度: 中等查看答案及解析
-
在相同条件下,总质量为2 g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
A. 2 g B. 1 g C. 18 g D. 无法计算
难度: 简单查看答案及解析
-
下列溶液能跟铜片反应,而且铜片的质量会减轻的是( )
A. 盐酸 B. FeCl3溶液 C. AgNO3溶液 D. NaCl溶液
难度: 简单查看答案及解析
-
下列离子方程式的表达正确的是( )
A. CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
B. NaHCO3溶液与稀硫酸混合:HCO3-+H+=H2O+CO2↑
C. NaHSO3溶液与NaHSO4溶液混合:HSO3-+HSO4-=SO42-+H20+SO2↑
D. Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
难度: 中等查看答案及解析
-
将足量的CO2气体通入下列澄清溶液中,最终仍为澄清溶液的是( )
A. 偏铝酸钠溶液 B. 氯化钡溶液 C. 含有氨水的NaCl饱和溶液 D. 饱和Na2CO3溶液
难度: 中等查看答案及解析
-
将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )

A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
难度: 中等查看答案及解析
-
A. 铝片放在不密封的容器里
B. 氢氧化钠溶液盛装在玻璃塞的试剂瓶中
C. 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D. 金属钠保存在石蜡油或煤油中
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是( )
A.
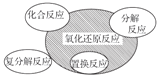 四种基本反应类型与氧化还原反应的关系
四种基本反应类型与氧化还原反应的关系B.
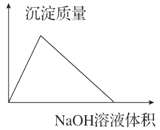 AlCl3溶液中滴加NaOH溶液生成沉淀的情况
AlCl3溶液中滴加NaOH溶液生成沉淀的情况C.
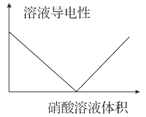 Ba(OH)2溶液中滴加硫酸溶液导电性的情况
Ba(OH)2溶液中滴加硫酸溶液导电性的情况D.
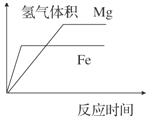 等体积、等浓度稀硫酸分别与足量铁和镁反应的情况
等体积、等浓度稀硫酸分别与足量铁和镁反应的情况难度: 困难查看答案及解析
-
下列各组物质混合后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②NaOH溶液和CuSO4溶液
③金属镁投入到盐酸中 ④Na2O2投入到FeCl3溶液中
A. ①④ B. ③④ C. ②③ D. ①③④
难度: 困难查看答案及解析
-
下列实验的现象描述或对应的离子方程式,不正确的是( )
A. 氯化亚铁溶液在空气中慢慢滴入过量氨水,产生白色沉淀:Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+
B. 氢氧化铁胶体中滴入足量HI溶液,先产生红褐色沉淀,后沉淀溶解变成棕黄色溶液:Fe(OH)3+3H+=Fe3++3H2O 2Fe3++2I-=2Fe2++I2
C. 明矾溶液中逐滴滴入氢氧化钡溶液产生白色沉淀,并不斷增加:2A13++3SO42-+3Ba2++60H-=3BaSO4↓+2Al(OH)3↓ 2Al(OH)3+SO42-+Ba2++20H-=3BaSO4↓+2AlO2-+4H2O
D. 澄清石灰水与少量小苏打溶液混合,产生白色沉淀: Ca2++OH-+HCO3-=CaCO3↓+ H2O
难度: 困难查看答案及解析
-
将铁的化合物溶于盐酸,滴加KSCN溶液,不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. Fe2O3 B. FeCl3 C. Fe2(SO4)3 D. FeO
难度: 中等查看答案及解析