-
下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
A.盐酸,水煤气,醋酸,干冰 B.冰醋酸,盐酸,硫酸钠,乙醇
C.苛性钠,石灰石,铁,硫酸钡 D.胆矾,漂白粉,氯化钾,氯气
难度: 简单查看答案及解析
-
某学生做完实验以后,采用以下方法分别清洗所用仪器:
(1)用稀硝酸清洗做过银镜反应的试管;
(2)用酒精清洗做过碘升华的烧杯;
(3)用浓盐酸清洗做过高锰酸钾分解实验的试管;
(4)用盐酸清洗长期存放过三氯化铁溶液的试剂瓶;
(5)用氢氧化钠溶液清洗盛过苯酚的试管。你认为他的操作:
A.(2)不对 B.(3)、(4)不对 C.(4)、(5)不对 D.全部正确
难度: 简单查看答案及解析
-
有一种气体在标准状况下体积是4.48升,质量是14.2g,则该气体的摩尔质量是
A.28.4 B.28.4g·mol-1 C.71 D.71g·mol-1
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡的标志是
A.单位时间生成 n 摩尔的A2同时生成 n 摩尔的AB
B.容器内的总压不随时间变化
C.单位时间生成 2n 摩尔的AB同时生成 n 摩尔的B2
D.单位时间生成 n 摩尔的A2同时生成 n 摩尔的B2
难度: 简单查看答案及解析
-
99毫升0.1 mol/L盐酸和101毫升0.05 mol/L氢氧化钡溶液相混和后,溶液的pH值为
A.1.7 B.10.7 C.11 D.11.3
难度: 简单查看答案及解析
-
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
A.在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.甲原子的最外层电子数比乙原子的最外层电子数少
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A.在碳酸氢钙溶液中加入盐酸:HCO3- + H+ ==CO2↑+ H2O
B.把金属铁放入稀硫酸中:2Fe + 6H+==2Fe3+ + 3H2↑
C.向氯化亚铁溶液中通入氯气:Fe2+ + Cl2==Fe3+ + 2Cl-
D.硫化钠水【解析】
S2- + 2H2O==H2S↑ + 2OH-难度: 简单查看答案及解析
-
相同温度、相同物质量浓度的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④Na2CO3按pH值由大到小的顺序排列,正确的是
A.④>①>③>② B.①>④>③>② C.①>②>③>④ D.④>③>①>②
难度: 简单查看答案及解析
-
有关下图所示原电池的叙述不正确的是

A.电子沿导线由Cu片流向Ag片
B.正极的电极反应是Ag++e-=Ag
C.Cu片上发生氧化反应,Ag片上发生还原反应
D.盐桥中盛装的是含琼脂的饱和氯化钾溶液,钾离子流向银半电池
难度: 简单查看答案及解析
-
下列说法正确的是
A.二氧化硫、三氧化硫互为同分异构体
B.碘晶体、碘蒸气是同素异形体
C.氕、氘、氚互为氢元素的同位素
D.乙炔、苯的最简式同为(CH)n,两者互为同系物
难度: 简单查看答案及解析
-
下列说法中正确的是
A.汽油燃烧时将全部的化学能转化为热能
B.向饱和AgCl溶液中加入盐酸,Ksp变大
C.若存在简单阴离子R2-,则R一定属于VIA族
D.最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼性强
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值。下列有关叙述一定正确的是
A.标准状况下,2.24L H2O含有的分子数等于0.1NA
B.1 mol Na2O2所含阴离子数为2NA
C.含有lmol Fe(OH)3的氢氧化铁胶体中胶粒个数为NA
D.在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA
难度: 简单查看答案及解析
-
NaHA是二元酸H2A的酸式盐,下列说法正确的是
A.若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸
B.若NaHA的水溶液呈碱性,则HA-只发生水解
C.无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1︰1
D.无论H2A是强酸还是弱酸,NaHA晶体中的阴阳离子个数比都是1︰l
难度: 简单查看答案及解析
-
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O-2e-→SO42- + 4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
A.NaClO B.ClO2 C.HClO D.NaClO4
难度: 简单查看答案及解析
-
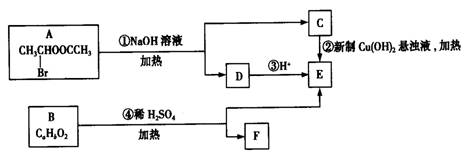
下列关于有机化学实验的说法正确的是
A.实验室制取乙烯的反应原理:C2H5OH
C2H4 ↑+ H2O
B.实验室制取C2H2,一般用碳化钙跟饱和食盐水反应以适度减缓反应速率
C.实验室分离苯和苯酚的混合物,可采用溴水
D.由1—溴丁烷跟氢氧化钠醇溶液共热,可以制得两种烯烃
难度: 简单查看答案及解析
-
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。

下列说法正确的是
A.β—紫罗兰酮可使酸性KMnO4溶液褪色
B.1mol中间体X最多能与2molH2发生加成反应
C.维生素A1易溶于NaOH溶液
D.β—紫罗兰酮与中间体X互为同系物
难度: 简单查看答案及解析