-
下列说法正确的是
①正常雨水的pH为7.0,酸雨的pH小于7.0;②严格执行机动车尾气排放标准有利于防止大气污染;③使用二氧化硫和某些含硫化合物进行增白的食品会损害人体健康;④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害;⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向养鱼水库。
A.①②③ B.①④⑤ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
新课程倡导合作学习和探究学习。科学的假设与猜想是科学探究的前提,在下列假设(猜想)引导下的探究肯定没有意义的选项是
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应生成的气体可能是O2
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuO
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性
难度: 中等查看答案及解析
-
下列说法正确的是
A.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质
B.标准状况下,1 mol Na2O2和22.4 L SO2反应,转移电子数目为NA
C.等物质的量Cl2和SO2同时通入品红溶液,褪色更快
D.在Na2O2中阴阳离子所含的电子数目相等
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A.
用热的纯碱溶液洗去油污
Na2CO3可直接与油污反应
B.
源白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D.
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含Cu2+的溶液中置换出铜
难度: 中等查看答案及解析
-
如图为周期表中短周期的一部分。已知a原子最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是
A.元素a的最高价氧化物对应水化物的酸性比b的弱
B.元素a的原子半径比d的大
C.元素a的单质在空气中燃烧会导致“温室效应”
D.元素a的单质是一种良好的半导体材料
难度: 中等查看答案及解析
-
下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是
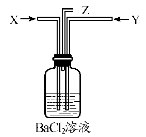
A.洗气瓶中产生的沉淀是碳酸钡 B.在Z导管出来的气体中有二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡 D.在Z导管口有红棕色气体出现
难度: 中等查看答案及解析
-
同主族元素所形成的同一类化合物,其结构和性质相似。化合物PH4I是一种无色晶体,下列对它的描述错误的是
A.它是共价化合物 B.在加热时,它能分解
C.它不能跟碱发生反应 D.它可由PH3和HI化合而成
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2= 2NH4++SO32-+H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3=3Fe3++NO↑+3H2O
C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
难度: 中等查看答案及解析
-
将5.6 g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15 mol,该混合气体中NO与NO2的体积比可能是
A.1∶2 B.2∶1 C.3∶2 D.3∶1
难度: 中等查看答案及解析
-
用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中,滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是
A.现象①中产生的红棕色气体为NO2
B.产生现象②的原因是NO2与水反应
C.产生现象③的原因是铜与稀硝酸反应
D.最终瓶内溶液中的溶质一定只有Cu(NO3)2
难度: 中等查看答案及解析
-
下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是
A.向漂白粉浊液中通入过量的CO2
B.向带有氧化膜的铝片中加入盐酸
C.向含有1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
D.向含有1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
难度: 中等查看答案及解析
-
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4×10-7
K2=6×10-11
A.向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O = 2Cl - + 2HClO + CO2↑
B.向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2 = Cl - +ClO - +2CO2↑+ H2O
C.向NaClO溶液中通少量CO2:CO2 + NaClO + H2O= NaHCO3 + HClO
D.向NaClO溶液中通过量CO2:CO2 + 2NaClO + H2O = Na2CO3 + 2HClO
难度: 中等查看答案及解析
-
实验:①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1NaOH溶液等体积混合得到浊液;
②取少量①中浊液,滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀; ④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
下列说法中不正确的是
A.将①中所得浊液过滤,所得滤液中含很少量Mg2+
B.①中浊液中存在溶解平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D.NH4Cl溶液中的NH
可能是④中沉淀溶解的原因
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
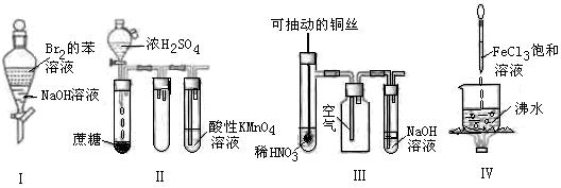
A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl- 。下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2 4 3 2 2 6 B.0 2 1 0 1 2 C.2 0 1 2 0 2 D.2 2 2 2 1 4
难度: 中等查看答案及解析
-
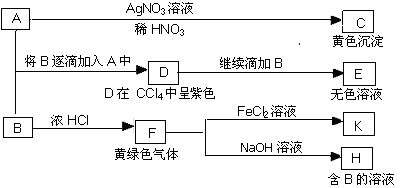
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图所示。
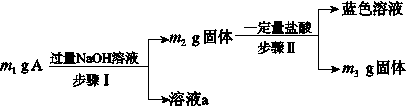
下列分析不正确的是( )
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
难度: 中等查看答案及解析