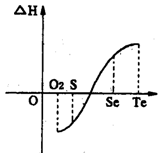
-
下列说法正确的是
A.明矾和漂白粉常用于水处理,两者的作用原理相同
B.利用潮汐发电是将化学能转化为电能
C.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
D.2009年12月中旬在哥本哈根召开的国际气候会议受到全球政要的广泛关注,减少工业生产大量排放二氧化碳等温室气体以抵制全球气候变暖成为该会议的主题
难度: 中等查看答案及解析
-
下列叙述正确的是
A.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
D.一定条件下,冰醋酸在稀释过程中导电能力逐渐减弱
难度: 中等查看答案及解析
-
下列说法正确的是
A.非金属元素组成的化合物一定是共价化合物
B.离子化合物的熔点一定比共价化合物的高
C.元素周期律是元素的性质随元素相对原子质量的递增发生周期性递变的规律
D.含有阴离子的化合物一定含有阳离子
难度: 中等查看答案及解析
-
已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是PbSO4+2CH3COO-
(CH3COO)2Pb+
,据此判断醋酸铅是
A.易溶强电解质 B.易溶弱电解质 C.难溶强电解质 D.难溶弱电解质
难度: 中等查看答案及解析
-
下列有关比较中,大小顺序排列错误的是
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰
C.结合H+的能力:
>CH3COO->
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 中等查看答案及解析
-
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 中等查看答案及解析
-
下列用来表示物质变化的化学反应中,正确的是
A.钢铁腐蚀时可能发生的正极反应:4OH--4e-
2H2O+O2↑
B.表示中和热的离子方程式:H++OH-
H2O;△H=-57.3kJ/mol
C.明矾水解反应的离子方程式:Al3++3H2O
Al(OH)3+3H+
D.硫酸铵溶液与氢氧化钠溶液混合共热的离子方程式:
+OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
在同一溶液中,含有
、I-、Ba2+、Cl-等离子,则该溶液的pH和介质是
A.pH=1,硝酸溶液为介质 B.pH=3,硫酸溶液为介质
C.pH=8,次氯酸钠溶液为介质 D.pH=12,氨水为介质
难度: 中等查看答案及解析
-
在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO4、KCl、MgCl2、Al2(SO4)3和Fe2(SO4)3溶液,这种试剂是
A.NaOH B.NH3·H2O C.AgNO3 D.BaCl2
难度: 中等查看答案及解析
-
下列实验装置,试剂选用或操作正确的是

A.除去NO中的NO2 B.铁制品表面镀锌
C.稀释浓硫酸 D.制备少量O2
难度: 中等查看答案及解析
-
在某固定容积的密闭容器中充入1mol A,一定条件下建立如下化学平衡:aA(g)
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是
A.在建立新平衡的过程中,A分解的速率与B消耗的速率之比为a :b
B.在建立新平衡的过程中,混合气体的密度逐渐减小
C.重新达平衡时,A的转化率一定增大
D.若a=b+c,重新达平衡时,B的体积分数不变
难度: 中等查看答案及解析
-
下列各组物质中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中(如图所示),最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)

难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期主族元素,下图为周期表的一部分。下列说法正确的是

A.通常情况下,X元素只存在两种氧化物
B.Y元素气态氢化物的还原性最强
C.X元素的非金属性比Y元素非金属性强
D.Z和X可能以共价键结合形成一种无机非金属材料
难度: 中等查看答案及解析
-
近年来研制的NH3气体可用作氟化氢一氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2
NF3+3H4F,下列说法不正确的是
A.NF3的形成过程用电子式可表示为
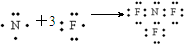
B.NF3的氧化性大于F2
C.NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价键
难度: 中等查看答案及解析
-
参照反应Br+H2
HBr+H的能量对反应历程的示意图,下列叙述中正确的是
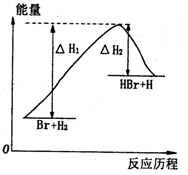
A.正反应为吸热反应
B.加入催化剂,该化学反应的反应热减少
C.正反应为放热反应
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
室温下,下列图形与实验过程相符合的是
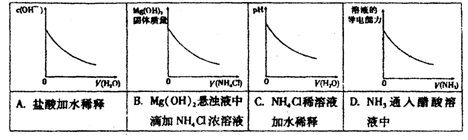
难度: 中等查看答案及解析