-
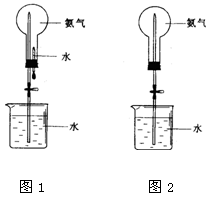
检验某未知溶液中是否含有SO42-的下列操作中最合理的是
A.加入硝酸酸化的Ba(NO3)2溶液
B.先加HNO3酸化,再加Ba(NO3)2溶液
C.先加盐酸酸化,再加BaCl2溶液
D.加入盐酸酸化了的BaCl2溶液
难度: 简单查看答案及解析
-
下列与生活相关的叙述不科学的是( )
A. 经过氯化铵溶液浸泡幕布,可以防止幕布着火
B. 在自来水的净化处理时,常使用明矾
C. 植物吸收氮肥,属于氮的固定
D. 在煤的燃烧过程中添加生石灰,可以有效防止酸雨的产生
难度: 简单查看答案及解析
-
通过单质之间直接化合,难以得到的是( )
A. Mg3N2 B. NO2 C. NO D. Cu2S
难度: 中等查看答案及解析
-
可以用浓硫酸干燥的气体是 ( )
A. H2S B. HBr C. SO2 D. NH3
难度: 简单查看答案及解析
-
下列干燥的气体,在常温下能够大量共存的是( )
A. NO2和O2 B. NH3和HCl C. H2S和SO2 D. NO和O2
难度: 中等查看答案及解析
-
NO2和Br2蒸汽都是红棕色、有刺激性气味的气体。下列不能用来区别这两种气体的试剂是( )
A. CCl4 B. 蒸馏水 C. 浓硫酸 D. AgNO3溶液
难度: 中等查看答案及解析
-
下列关于铵盐的叙述:①铵盐中氮元素化合价都是-3价;②铵盐都是晶体,都易溶于水;③铵盐与碱共热放出氨气;④铵盐都不能与酸反应;⑤铵盐都易分解。其中正确的是( )
A. ①②③ B. ②③④ C. ③④⑤ D. ②③⑤
难度: 简单查看答案及解析
-
下列反应中,不能产生黑色固体的是( )
A. 铜在硫蒸气中燃烧 B. 铁粉和硫粉混合后点燃
C. H2S通入硫酸亚铁溶液中 D. H2S通入硫酸铜溶液
难度: 简单查看答案及解析
-
为除去CO2气体中混有的少量SO2气体杂质,可以采用的方法是( )
A. 通过酸性高锰酸钾溶液 B. 通过澄清石灰水
C. 通过饱和Na2CO3溶液 D. 通过氢氧化钠溶液
难度: 中等查看答案及解析
-
已知:4NH3+5O2→4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L∙min)]表示,则正确的关系是( )
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
难度: 简单查看答案及解析
-
常温下,向100mL0.05mol/L氢硫酸中逐渐通入氯气。下列叙述正确的是( )
A. 溶液c(H+)先变大后变小 B. 溶液导电能力逐渐增强
C. 氢硫酸完全反应生成1.6g硫 D. 反应的离子方程式为:S2-+Cl2→2Cl-+S↓
难度: 中等查看答案及解析
-
某温度下,容积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
2Z(g)+W(s)+Q,下列叙述正确的是( )
A. 加入少量W,v(逆)增大 B. 压强不变时,反应达到平衡状态
C. 升高温度,v(逆)、v(正)都增大 D. 平衡后加入X,X转化率增大
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是 ( )
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 胆矾受热后变色,说明胆矾受热不稳定
C. 常温下,浓硫酸可以用铝罐贮存,说明铝与浓硫酸不反应
D. 反应FeS+H2SO4→FeSO4+H2S↑能进行,说明H2S比H2SO4酸性弱
难度: 中等查看答案及解析
-
向含有下列离子的各组溶液中分别通入一定量相应气体,各离子还能大量存在的是( )
A. Cu2+、SO42-,通硫化氢 B. Na+、S2O32-,通氯化氢
C. Ba2+、C1-,通二氧化硫 D. Ba2+、NO3-,通二氧化硫
难度: 中等查看答案及解析
-
恒温下,V升容器中加入a mol HI使之分【解析】
2HI(g)H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
A. 减压时,v(逆)增大,v(正)减小,平衡向逆反应方向移动
B. 若加入2a mol HI,则平衡常数变为2倍
C. 加压时,v(逆)、v(正)均不变,平衡不移动
D. 若保持压强不变,通入氦气,则v(逆)、v(正)均减小,平衡不移动
难度: 中等查看答案及解析
-
能用离子方程式H++OH-→H2O表示的反应是( )
A. 稀硫酸和氢氧化钾 B. 稀硫酸和氢氧化钡溶液
C. 氢硫酸和氢氧化钠溶液 D. 稀硝酸和氨水
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应A(g)═B(g)+C(g),若反应物的浓度由2mol•L﹣1降到0.8mol•L﹣1需要20s,那么反应物浓度再由0.8mol•L﹣1降到0.2mol•L﹣1所需要的时间为( )
A.10 s B.大于10 s C.小于10 s D.无法判断
难度: 中等查看答案及解析
-
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)
CH3OH(g)。T1、T2温度下甲醇物质的量随时间变化的关系如图所示,下列判断正确的是 ( )
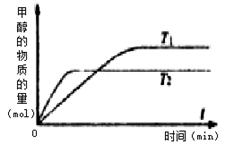
A. 温度T1>温度T2
B. 正反应为吸热反应
C. 若平衡常数K值变大,则平衡移动时v(逆)先减小后增大
D. 若平衡常数K值变小,平衡向正反应方向移动
难度: 中等查看答案及解析
-
常温下,将甲针筒内20mLH2S推入含有10 mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
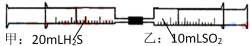
A. 有淡黄色固体生成
B. 有无色液体生成
C. 气体体积缩小
D. 最终约余15mL气体
难度: 简单查看答案及解析
-
将0.96 g铜片加入500 mL0.2 mol/L稀硝酸中,充分反应,现欲使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入0.2 mol/L NaOH溶液体积为( )
A. 300 mL B. 400 mL C. 450 mL D. 500 mL
难度: 中等查看答案及解析