-
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+ S2(g)(正反应吸热)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+ S2(g)(正反应吸热)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.31 mol,反应10 min后,测得气体为l.37 mol,则10 min 内H2的平均生成速率为________________。
(2)某温度时,判断H2S的转化率达到最大值的依据是________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.单位时间里分解的H2S和生成的H2一样多 d.反应物不再转化为生成物
(3)如右图所示,该可逆反应在t0时因改变某外界条件而打破原平衡,在t1时达到新的平衡状态,因此推断,t0时改变的外界条件可能是__________________、___________________。
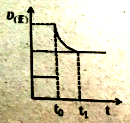
(4)在容器体积不变的情况下,如果要提高H2S的转化率,可采取的一种措施是_____________。
(5)在实验室,若将H2S通入浓硫酸中,发生的化学反应的方程式是:__________。
(6)若将H2S完全燃烧后,并用碳酸钠与碳酸氢钠的混合溶液吸收生成气体SO2,发生如下反应: 2Na2CO3+SO2+H2O→ 2NaHCO3+Na2SO3
充分反应后(无CO2逸出),所得溶液组成如表:
| 物质 | Na2CO3 | NaHCO3 | Na2SO3 |
| 物质的量(mol) | 2 | 12 | 4 |
则原吸收液中碳酸钠与碳酸氢钠的物质的量之比________________________。
-
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)。现在3L密闭容器中进行H2S分解实验。某温度时,测得反应体系中有气体1.31mol,反应10min后,测得气体为1.37mol,则10min内H2的平均生成速率为________________。
2H2(g)+S2(g)。现在3L密闭容器中进行H2S分解实验。某温度时,测得反应体系中有气体1.31mol,反应10min后,测得气体为1.37mol,则10min内H2的平均生成速率为________________。
-
氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:
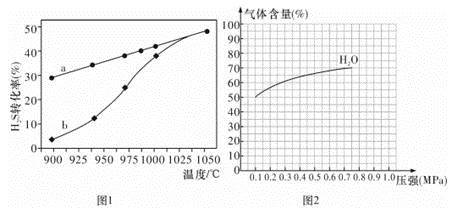
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
2H2(g) + S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H ______0(填“>”“<”或“=”)。
②若985 ℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=________(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因: _______________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s)+H2O(g)==CO(g)+H2(g)△H=+131.6kJ/mol
II.CO(g)+H2O(g)==CO2(g)+H2(g)△H=-43kJ/mol
III.CaO(s)+CO2(g)==CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s)==CaCO3(s)+2H2(g)的△H =________(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=_________(用K1、K2、K3表示)。
② 对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是___________。(填字母编号)
| A.适当的降低体系的温度 | B.压缩容器的体积 |
| C.用特殊材料吸收氢气 | D.增加CaO的量 |
③ 图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O) = 2c(H2)=" 2c(CO)" =" 2" mol/L,试根据H2O的体积百分含量变化曲线,补充完整 CO的变化曲线示意图。
-
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ∆H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法错误的是( )
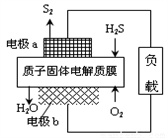
A. 电池工作时,电子从电极a经负载流向电极b
B. 实际工作中当反应生成64gS2时,电池内部释放632kJ电能
C. 电极a上发生的电极反应为:2H2S - 4e-= S2 + 4H+
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入正极区
-
在1200℃时,天然气脱硫工艺中会发生下列反应
① H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
② 2H2S(g)+SO2(g)=S2 (g)+2H2O(g) △H2
③ H2S(g)+O2(g)=S(g)+H2O(g) △H3
④ 2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3) B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2-3△H3) D.△H4=(△H1-△H2-3△H3)
-
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ O2(g)=SO2(g)+H2O(g)△H1
O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g)△H2
S2(g)+2H2O(g)△H2
③H2S(g)+ O2(g)=S(g)+H2O(g)△H3
O2(g)=S(g)+H2O(g)△H3
④S(g)= S2(g)△H4
S2(g)△H4
则△H4的正确表达式为( )
A. △H4= (△H1+△H2-3△H3) B. △H4=
(△H1+△H2-3△H3) B. △H4= (3△H3-△H1-△H2)
(3△H3-△H1-△H2)
C. △H4= (△H1+△H2-3△H3) D. △H4=
(△H1+△H2-3△H3) D. △H4= (△H1-△H2-3△H3)
(△H1-△H2-3△H3)
-
下列反应属于吸热反应的是( )
A.氢气在氧气中燃烧
B.葡萄糖在人体内氧化分解
C.碳酸钙高温分解成氧化钙和二氧化碳
D.锌粒与稀H2SO4反应制取H2
-
下列反应属于吸热反应的是( )
①锌粒与稀H2SO4反应制取H2 ②氢气在氧气中燃烧 ③碳酸钙高温分解成氧化钙和二氧化碳 ④氢氧化钾和硫酸中和 ⑤Ba(OH)2·8H2O与NH4Cl反应 ⑥氢气还原氧化铜 ⑦葡萄糖在人体内氧化分解 ⑧钢铁制品生锈的反应
A.①②③④ B.③⑤⑥ C.③⑤⑥⑦ D.①②④⑧
-
工业上利用氢气与氮气在高温、高压、催化剂作用下制取氨气:N2+3H2 2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2NH3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,H2不可能100%的转化为NH3
C.为了提高H2的转化率,应适当提高N2的浓度
D.达到平衡时,N2的浓度和H2的浓度之比为1:3
-
下列反应属于放热反应的是1;属于吸热反应的是2。
A.锌粒与稀H2SO4反应制取H2 B.氢气在氧气中燃烧
C.碳酸钙高温分解成氧化钙和二氧化碳 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl反应 F.氢气还原氧化铜
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
2H2(g)+ S2(g)(正反应吸热)。现在3L密闭容器中,控制不同温度进行H2S分解实验。


