-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A.
用热的纯碱溶液洗去油污
Na2CO3可直接与油污反应
B.
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与HN4Cl反应生成氨气会降低肥效
D.
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含Cu2+的溶液中置换出铜
难度: 中等查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+)/c(NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
难度: 简单查看答案及解析
-
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH= bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1 下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能(b-a+5.6c)/4kJ·mol-1
D.P-P键的键能为(5a-3b+12c)/8kJ·mol-1
难度: 简单查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
难度: 简单查看答案及解析
-
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
A.a点时溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
难度: 困难查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析
-
已知反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
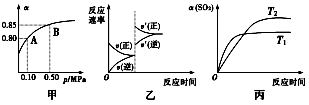
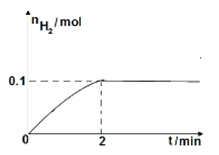
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
难度: 困难查看答案及解析
-
下列各组离子在指定条件下,一定能大量共存的是( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=1×10-1 mol·L-1的溶液中:Cu2+、Al3+、SO42-、NO3-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=1×10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、SO42-
难度: 困难查看答案及解析
-
H2S水溶液中存在电离平衡H2S
H++HS-和HS-
H++S2-。若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
难度: 中等查看答案及解析
-
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ•mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ•mol-1,则HCN在水溶液中电离的ΔH等于( )
A. +43.5 kJ•mol-1 B.-43.5 kJ•mol-1
C.-67.7 kJ•mol-1 D.+67.7 kJ•mol-1
难度: 困难查看答案及解析
-
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,NaF溶液的pH比NaCN溶液大
B.0.2 mol ·L-1NH4Cl和0.1 mol·L-1 NaOH溶液等体积混合后:
c(NH4+)>c(Cl—)>c(Na+)>c(OH-)>c(H+)
C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+)由大到小的顺序是:①>②>③>④
D.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
难度: 简单查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳气体,消耗掉8 mol/L的氢氧化钠溶液50 mL,则1 mol无水乙醇的燃烧放出的热量不可能是( )
A.10Q B.5Q~10Q C.3Q D.8Q
难度: 简单查看答案及解析
-
在容积一定的密闭容器中,反应2A
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
A.正反应是吸热反应,且A不是气态
B.正反应是放热反应,且A是气态
C.其他条件不变,加入少量A,该平衡向正反应方向移动
D.改变压强对该平衡的移动无影响
难度: 简单查看答案及解析
-
已知:t ℃时,2H(g)+Y(g)
2I(g) ΔH=-196.6 kJ·mol-1,t ℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
A.0.8 mol B.0.6 mol C.0.5 mol D.0.2 mol
难度: 简单查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
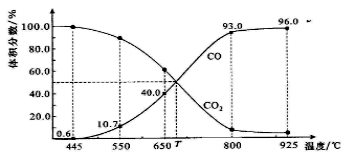
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率 为 25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 简单查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2 和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中的少
D.容器I中CO 的转化率与容器II中CO2 的转化率之和小于1
难度: 简单查看答案及解析