-
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ、SO2+2H2O+I2===H2SO4+2HI; Ⅱ、2HI H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
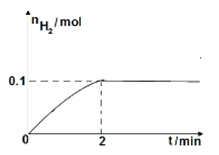
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)= 。
(3)实验室用Zn和稀硫酸制取H2,加入少量下列试剂中()产生H2的速率将增大(填字母)。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知2H2(g)+O2(g)=== 2H2O(l) △H=-572KJ·mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化为 。
(5)利用氢气合成二甲醚的三步反应如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
(6)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(7)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。

a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
-
(共7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是____________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
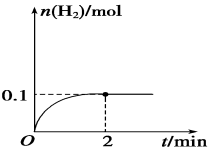
0~2 min内的平均反应速率v(HI)=____________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=____________。
2HI(g)的平衡常数K=____________。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
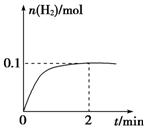
①0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K=________。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)=________。

相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.压强 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡________移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的________。
H++OH-)平衡________移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的________。
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
分解水制氢气的工业制法之一是硫.碘循环,主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中S02还原性比HI强
c.循环过程中需补充H20
d.循环过程中产生lmol02的同时产生lmolH2

(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。 0~2min 内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g) 的平衡常数表达式为K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g) 的平衡常数表达式为K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)S02在一定条件下可氧化生成SO3,其主反应为:2SO2 (g)+O2(g) 2SO3(g) △H<0,若此反应起始的物质的量相同,则下列关系图正确的是 。
2SO3(g) △H<0,若此反应起始的物质的量相同,则下列关系图正确的是 。

实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是 。
(4)实际生产用氨水吸收S02生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为 。
-
随着化石能源的减少,新能源的开发利用需求日益迫切。Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) △H=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) △H=b kJ·mol-1
2HI(g)=H2(g)+I2(g) △H=c kJ·mol-1则:2H2O(g)=2H2(g)+O2(g) △H=__________
-
氯气是一种清洁、高效新能源, 也是重要的化工原料。
(1)通过热化学循环在较低温度下由硫化氢分解制备氢气的反应系统原理为:
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ∆H1=-151kJ∙mol-1
2HI(aq)=H2(g)+I2(s) ∆H2=+110kJ∙mol-1
H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ∆H3=+61kJ∙mol-1
(热化学硫碘循环硫化氢分解联产氢气、硫磺系统)
通过计算可知,该系统制氢的热化学方程式为___________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为CO(g)+2H2(g)⇌CH3OH(g)ΔH= -116 kJ·mol-1。如图表示CO的平衡转化率(α)随温度和压强变化的示意图:
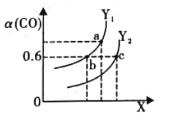
①X 表示的是______ (填“温度”或“压强”) ,理由是_________;Y1______Y2 (填“<”、“ >”或“=”)
②在2L恒容密闭容器中充入2 mol CO 和4 mol H2,一定条件下经过10 min 达到平衡状态c 点处。在该条件下,从开始至达到平衡状态v(CH3OH) =______ mol∙L-1∙min -1,平衡常数K=________(填最简分数)。平衡常数Ka、Kb、Kc的大小关系是______
③下列措施既能增大反应速率又能提高反应物转化率的是______ (填字母)。
A. 使用催化剂 B. 及时分离CH3OH C.升高温度 D.增大压强
(3) 已知燃料电池的比能最与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由大到小的顺序为_________。
-
科学家预测“氢能”将是21世纪最理想的新能源。化学家提出“硫-碘热循环法”制氢气,总反应方程式为: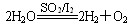 ,其循环过程分三步进行:
,其循环过程分三步进行:
(a) SO2+I2+2H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O。
下列分析不合理的是 ( )
A.由于硫酸很稳定,所以反应(c)最难进行
B.该循环过程不需加热,常温下就能进行
C.反应生成的SO2和I2可以循环使用
D.“硫-碘热循环法”耗能大,若利用太阳能,可大面积推广
H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O

CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CH3OCH3(g) + CO2 (g)的ΔH=_____ _;








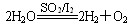 ,其循环过程分三步进行:
,其循环过程分三步进行: