-
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ、SO2+2H2O+I2===H2SO4+2HI; Ⅱ、2HI H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
H2+I2; Ⅲ、2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
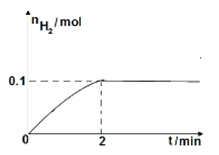
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)= 。
(3)实验室用Zn和稀硫酸制取H2,加入少量下列试剂中()产生H2的速率将增大(填字母)。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知2H2(g)+O2(g)=== 2H2O(l) △H=-572KJ·mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化为 。
(5)利用氢气合成二甲醚的三步反应如下:
①2H2(g) + CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③CO(g) + H2O(g)  CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
CH3OCH3(g) + CO2 (g)的ΔH=_____ _;
(6)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a.v生成(CH3OH)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(7)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。

a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
-
(共7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是____________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
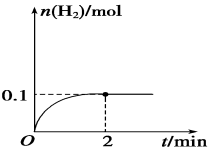
0~2 min内的平均反应速率v(HI)=____________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=____________。
2HI(g)的平衡常数K=____________。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
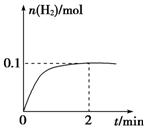
①0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K=________。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)=________。

相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.压强 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡________移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的________。
H++OH-)平衡________移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的________。
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
-
(题文)已知:①I2 + SO2 + 2H2O = 2HI + H2SO4;②2FeCl2 + Cl2 = 2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2根据上面反应判断,下列说法正确的是( )
A. 氧化性强弱顺序是:Fe3+ > SO2 > I2 > SO42-
B. 还原性强弱顺序是:SO2 > I- > Fe2+ > Cl-
C. 反应Cl2 + SO2 + 2H2O = 2HCl + H2SO4不能发生
D. Fe3+ 与I-在溶液可以大量共存
-
随着化石能源的减少,新能源的开发利用需求日益迫切。Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) △H=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) △H=b kJ·mol-1
2HI(g)=H2(g)+I2(g) △H=c kJ·mol-1则:2H2O(g)=2H2(g)+O2(g) △H=__________
-
分解水制氢气的工业制法之一是硫.碘循环,主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中S02还原性比HI强
c.循环过程中需补充H20
d.循环过程中产生lmol02的同时产生lmolH2

(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。 0~2min 内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g) 的平衡常数表达式为K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
H2(g)+I2(g) 的平衡常数表达式为K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)S02在一定条件下可氧化生成SO3,其主反应为:2SO2 (g)+O2(g) 2SO3(g) △H<0,若此反应起始的物质的量相同,则下列关系图正确的是 。
2SO3(g) △H<0,若此反应起始的物质的量相同,则下列关系图正确的是 。

实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是 。
(4)实际生产用氨水吸收S02生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为 。
-
利用太阳能热化学硫碘循环分解水制氢反应过程如下图所示:
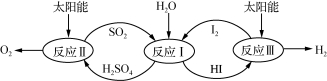
(1) 反应Ⅱ中涉及的热化学方程式为:
①H2SO4(l)=SO3(g)+H2O(g) ΔH=+177.3 kJ·mol-1
②2SO3(g) = 2SO2(g)+O2(g) ΔH=a kJ·mol-1
③2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550.2 kJ·mol-1则 a= ;
(2)反应Ⅰ得到的产物可用I2进行分离。该产物的溶液在过量I2的存在下会分成两层 :含低浓度I2的H2SO4溶液层和高浓度的I2的HI溶液层。
①区分两层溶液可加入的试剂为 (填化学式)。
②下列说法正确的是 (填序号)。
A. SO2在反应Ⅰ中作氧化剂
B. 加过量I2前,H2SO4溶液和HI不互溶
C. 两层溶液的密度存在差异
D. I2在HI溶液中比在H2SO4溶液中易溶
(3)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O也可制H2,其物质转化如右图所示。
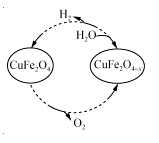
①氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式为 。
②若x=0.15,则1 mol CuFe2O4参与该循环过程理论上一次能制得标准状况下的H2体积为 L。
③CuFe2O4可用电化学方法得到,其原理如图所示, 则阳极的电极反应式为 。
则阳极的电极反应式为 。

H2+I2(g)

H++OH-)平衡________移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的________。









