-
25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变小
B.平衡向正反应方向移动
C.D的体积分数变大
D.a>c+d难度: 中等查看答案及解析
-
决定化学反应速率的主要原因是( )
A.参加反应物本身的性质
B.加入催化剂
C.温度和压强
D.各反应物和生成物的浓度难度: 中等查看答案及解析
-
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成CH4燃料电池.已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;通入O2的另一极,其电极反应是:O2+2H2O+4e-═4OH-,下列叙述不正确的是( )
A.通入CH4的电极为负极
B.该电池使用一段时间后应补充KOH
C.正极发生氧化反应
D.该电池工作时溶液中的阴离子向负极移动难度: 中等查看答案及解析
-
反应3A(g)⇌3B(?)+C(?)(正反应是吸热反应),随着温度的升高,气体平相对分子质量有变小的趋势,则下列判断正确的是( )
A.B和C都有可能是固体
B.B和C一定是气体
C.若C为固体,则B一定是气体
D.B和C一定都是固体难度: 中等查看答案及解析
-
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物具有的总能量的相对大小决定了反应是放热还是吸热
D.吸热反应一定要加热才能发生难度: 中等查看答案及解析
-
关于有效碰撞理论,下列说法正确的是( )
A.活化分子间所发生的所有碰撞为有效碰撞
B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大
C.升高温度,活化分子百分数增加,化学反应速率一定增大
D.增大压强,活化分子数一定增加,化学反应速率一定增大难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.光照新制的氯水时,溶液中c(H+)增大
B.对于2HI(g)⇌H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
C.反应CO(g)+NO2(g)⇌CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在101 kPa、25℃时,中和热为57.3 kJ/mol,则表示Ba(OH)2的稀溶液与足量稀硫酸反应的热化学方程式为:Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ/mol
B.在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量.则氢气表示燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ/mol
C.pH=11的氨水和pH=3的盐酸等体积混合后溶液显中性
D.在相同情况下,强电解质溶液的导电性比相同浓度弱电解质溶液的导电性强难度: 中等查看答案及解析
-
可逆反应:2NO2(g)⇌2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部难度: 中等查看答案及解析
-
铅蓄电池总反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列关于铅蓄电池的说法正确的是( )
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)→PbSO4(s)+2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-→Pb(s)+SO42-(aq)难度: 中等查看答案及解析
-
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2难度: 中等查看答案及解析
-
如图各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
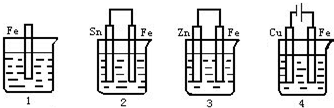
A.4>2>1>3
B.2>1>3>4
C.4>2>3>1
D.3>2>4>1难度: 中等查看答案及解析
-
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图,已知断裂1molN-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.根据以上信息和数据,则由N2气体生成1mol气态N4的△H为( )
A.-441kJ•mol-1
B.+441kJ•mol-1
C.-882kJ•mol-1
D.+882kJ•mol-1难度: 中等查看答案及解析
-
右图
为直流电源,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为电镀槽.接通电路后发现
上的c点显红色.为实现铁上镀铜,接通
后,使c.d两点短路.下列叙述正确的是( )
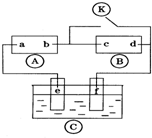
A.a为直流电源的负极
B.f电极为铁板
C.c极发生的反应为O2+4e-+2H2O=4OH-
D.电解质溶液不能用CuCl2溶液难度: 中等查看答案及解析
-
在100mLH2SO4和CuSO4的混合液中,用石墨作电极电解一段时间,两极均收到2.24L气体(标准状况),则原混合液中,Cu2+的物质的量浓度为( )
A.1mol•L-1
B.2mol•L-1
C.3mol•L-1
D.4mol•L-1难度: 中等查看答案及解析
-
如图,条件一定时,反应2NO(g)+O2(g)⇌2NO2(g)(正反应为放热)中NO的转化率R(NO)与T变化关系曲线图,图中有a、b、c、d 4个点,其中表示未达到平衡状态,且V逆<V正的点是( )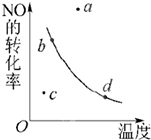
A.a点
B.b点
C.c点
D.d点难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③NaNO3溶液 ④CH3COONa固体 ⑤KCl溶液.
A.①②
B.②④⑤
C.②③⑤
D.②③④难度: 中等查看答案及解析
-
用惰性电极电解足量CuSO4溶液一段时间后,欲使溶液恰好恢复至电解前情况,可加入的物质是( )
A.CuSO4
B.Cu(OH)2
C.Cu
D.CuO难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.将水加热,KW增大,溶液的pH增大
B.向水中加入稀氨水,平衡正向移动,c(OH-)增加
C.向水中加入少量固体硫酸氢钠,c(H+)降低,KW不变
D.向水中加入少量固体CH3COONa,平衡正向移动,c(OH-)增加难度: 中等查看答案及解析