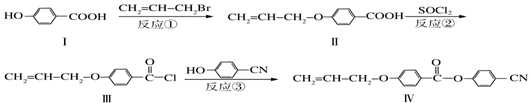
-
生活中处处有化学,下列有关说法正确的是( )
A.生活中常见的石英玻璃、普通玻璃、陶瓷都属于硅酸盐产品
B.棉、麻、丝、毛、油脂都是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.合金材料都是导体,可能含有非金属元素
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8gO2含有4NA个电子
B.1L0.1molL-1的氨水中有NA个NH4+
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1molNa被完全氧化生成Na2O2,失去个2NA电子
难度: 中等查看答案及解析
-
能在水溶液中大量共存的一组离子是( )
A.H+、Fe3+、I-、SO42- B.Al3+、Mg2+、HCO3-、Cl-
C.K+、Ag+、Ca2+、PO43- D.NH4+、Na+、SO42-、Cl-
难度: 中等查看答案及解析
-
有关下图的说法正确的是( )

A.构成原电池时溶液中SO42- 移向Cu极
B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+
C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极
D.a和b分别接直流电源正、负极,Fe片上有气体产生
难度: 中等查看答案及解析
-
下列实验操作正确且能达到目的是( )
A.将AlCl3溶液蒸发结晶提取无水AlCl3
B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁的CaSO4
C.在淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2悬浊液并加热,产生红色沉淀
D.将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl
难度: 中等查看答案及解析
-
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法不正确的是( )
A.分别升高温度,两种溶液的pH均减小
B.相同温度下两种溶液的pH:Na2CO3> NaHCO3
C.分别加入少量NaOH,两溶液中c(CO32-)均增大
D.两溶液均存在c(Na+) + c(H+)=c(OH-) + c(HCO3-) + 2c(CO32-)
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是( )
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.元素B和C的最高价氧化物对应水化物的碱性:B>C
D.B、C、D的最高价氧化物对应的水化物能相互反应
难度: 困难查看答案及解析
-
下列实验装置设计正确、且能达到目的的是( )

A.实验Ⅰ:制备金属钠 B.实验Ⅱ:制取氢氧化亚铁并观察其颜色
C.实验Ⅲ:制取少量的氢氧化铝 D.实验Ⅳ:比较两种物质的热稳定性
难度: 中等查看答案及解析