-
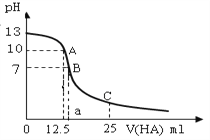
在Na2CO3溶液中,下列说法错误的是
A. 溶液呈碱性
B. 若升高温度,溶液中c(OH─)增大
C. 若加入少量NaOH固体,溶液中c(CO32─)增大
D. 溶液中的离子浓度存在关系:c(Na+)+c(H+)=c(OH─)+c(HCO3─)+c(CO32─)
难度: 中等查看答案及解析
-
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
难度: 简单查看答案及解析
-
常温下,下列离子浓度关系正确的是( )
A. pH=4的CH3COOH溶液中,c(H+)= c(CH3COO-)=4.0mol·L-1
B. pH=5的CH3COOH和CH3COONa混合溶液中,c(CH3COO-)>c(Na+)
C. 0.1 mol·L-1CH3COONa溶液中,c(Na +)>c(OH-)>c(CH3COO-)>c(H+)
D. 0.1 mol·L-1CH3COONa溶液中,c(Na +)= c(CH3COO-)+ c(OH-)
难度: 困难查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,由甲醇、空气、KOH溶液构成.则下列说法正确的是
A. 电池放电时通入空气的电极为负极
B. 电池的总反应式为2CH3OH+3O2═2CO2+4H2O
C. 电池放电时,电解质溶液中K+ 向正极移动
D. 电池放电时每消耗1 mol CH3OH,正极上反应的物质失去6 mol电子
难度: 中等查看答案及解析
-
在下列反应中,反应物的总能量低于生成物的总能量的是
A. 2H2+O2
2H2O B. CaCO3
CaO+CO2↑
C. CaO+CO2=CaCO3 D. C2H5OH+3O2
2CO2+3H2O
难度: 中等查看答案及解析
-
同温等体积等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A. 醋酸大 B. 盐酸大 C. 仍相同 D. 无法判断
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能减少反应物活化分子百分数、降低反应速率的是
A. 增大压强 B. 移除一部分SO3 C. 使用催化剂 D. 降低温度
难度: 中等查看答案及解析
-
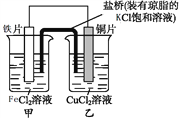
某学生欲完成反应2HCl+2Ag
2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是( )
A.
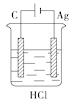 B.
B. 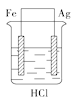 C.
C. 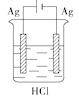 D.
D. 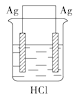
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
A. υ(D)=0.4 mol / (L·s)
B. υ(C)=0.5 mol / (L·s)
C. υ(B)=0.6 mol / (L·s)
D. υ(A)=0.15 mol / (L·s)
难度: 中等查看答案及解析
-
A. ③⑥①②⑤④ B. ⑤①②⑥④③
C. ⑤④③②①⑥ D. ③①②④⑤⑥
难度: 中等查看答案及解析
-
下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是
A. 各常数的大小与温度有关 B. 各常数的大小说明平衡体系正反应的程度大小
C. 若温度升高则各常数一定增大 D. 各常数越大反应物平衡转化率越大
难度: 中等查看答案及解析
-
氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+ SO2(g)
N2(g)+S(l)+4H2O(g) ΔH﹤0 。下列有关说法正确的是
A. 当v(H2)= v(H2O)时,达到平衡
B. 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C. 使用高效催化剂可提高NO的平衡转化率
D. 化学平衡常数表达式为
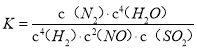
难度: 中等查看答案及解析
-
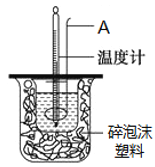
如图所示实验装置,下列说法不正确的是
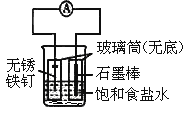
A. 装置为铁的吸氧腐蚀实验
B. 一段时间后,向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红
C. 一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀出现
D. 若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀
难度: 中等查看答案及解析
-
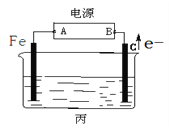
用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
难度: 困难查看答案及解析
-
在某恒容的密闭容器中,可逆反应A(g)+B(g)
xC(g)有如图所示的关系曲线,下列说法正确的是
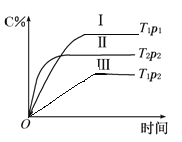
A. 温度:T1>T2 B. 压强:p1>p2
C. 正反应是放热反应 D. x的值是2
难度: 中等查看答案及解析
-
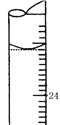
一定温度下,水溶液中H+ 和OH─ 的浓度变化曲线如图,下列说法正确的是
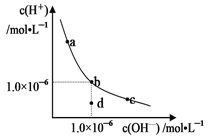
A. 该温度下,a点溶液呈碱性
B. 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性
C. 该温度下,加入NaOH可能引起由b向c的变化
D. b点时,升高温度,可能引起由b向d的变化
难度: 中等查看答案及解析