-
硫酸是强酸,中学阶段常将硫酸在水溶液中看作完全电离,但事实是:硫酸在水中的第一步电离是完全的,第二步电离程度并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-⇌H++SO42-请据此事实判断,下列说法正确的是( )
A.将等浓度、等体积的H2SO4溶液与BaCl2溶液混合,发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.将等浓度的H2SO4溶液与NaOH溶液按1:2的体积比混合,所得溶液中的离子浓度由大到小的关系为c(Na+)>c(SO42-)>c(OH-)>c(H+)
C.25℃时,如果0.10 mol/L H2SO4溶液的c(H+)=0.11mol/L,则0.10 mol/L的H2SO4溶液中c(HSO4-)>0.1mol/L
D.25℃时,0.10 mol/LNaHSO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-)难度: 中等查看答案及解析
-
9.25℃时,将某一元酸HA和NaOH溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的pH如下表:(假设混合后溶液体积等于混合前两种溶液的体积之和,下同)
则下列说法正确的是( )实验编号 HA物质的量浓度
(mol/L)NaOH物质的量浓度
(mol/L)混合溶液的pH ① 0.1 0.1 pH=9 ② c 0.2 pH=7 ③ 0.2 0.1 pH<7
A.第①组所得混合溶液中由水电离出的c(OH-)=1×10-9 mol•L-1
B.第②组中c>0.2,所得混合溶液中离子浓度c(A-)>c(Na+)
C.第③组所得混合溶液中各离子浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH-)
D.25℃时,将0.1mol/L的NaA溶液和0.1mol/L的NaOH溶液等体积混合,所得混合液中A-离子浓度大于第③组所得混合溶液中A-离子浓度难度: 中等查看答案及解析
-
以下是否正确( )
A.苯酚溶液与碳酸钠溶液反应CO2:C6H5OH+CO32-→C6H5O-+CO2↑+H2O
B.CH3CHBrCOOHCH2=CHCOONa+NaBr+2H2O
C.碳酸钠水【解析】
CO32-+H2O⇌HCO3-+OH-
D.碳酸氢钠溶液中碳酸氢钠的水【解析】
HCO3-+OH-⇌CO32-+H2O
E.在标准状况下,H2O2与水任意比例互溶,可推测H2S与水任意比例互溶
F.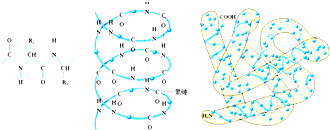
该结构为蛋白质分子的三级结构:一级结构为多肽链、二级结构为螺旋结构、三级结构为盘曲折叠的三维结构难度: 中等查看答案及解析
-
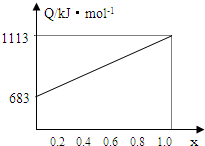
三硫化磷(P4S3)是一种针状晶体,易燃、有毒,分子结构如图所示,已知其燃烧热为3677kJ/mol(磷元素被氧化为P4O10(s )),下列有关P4S3的说法中正确的是( )
A.分子中每个原子最外层均达到8电子稳定结构
B.P4S3中磷元素均为+3价
C.热化学方程式为P4S3+8O2=P4O10+3 SO2;△H=-3677kJ/mol
D.三硫化磷(P4S3)属于是原子晶体,分子中只存在极性共价键难度: 中等查看答案及解析
-
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度关系正确的是( )
A.c(Na+)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Na+)=c(NH4+)+c(NH3.H2O)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)=c(Cl-)>c(NH4+)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
10.在100mL0.2mol/LNH3.H2O溶液中,欲使NH3.H2O溶液pH变小,可采取的方法是( )
A.加少量0.2mol/L NH4Cl溶液
B.加少量0.2mol/LNaOH溶液
C.稍微加热(不考虑NH3.和H2O的挥发)
D.加20mL0.5mol/LNH3.H2O溶液难度: 中等查看答案及解析
-
在相同物质的量浓度的下列盐溶液中,c(NH4+)最大的是( )
A.NH4Cl
B.NH4HCO3
C.CH3COONH4
D.NH4HSO4难度: 中等查看答案及解析
-
25℃时,pH=13的氢氧化钠溶液与pH=2的硫酸溶液混合后溶液pH=11,则氢氧化钠溶液与盐酸溶液的体积比为(设混合后体积等于混合前溶液体积之和 )( )
A.11:1
B.1:1
C.9:1
D.1:9难度: 中等查看答案及解析
-
2009高二上:16.25℃时,下列关于等体积、等pH的NaOH溶液和氨水溶液的说法正确的是( )
A.两溶液OH-浓度:NaOH溶液中大于氨水溶液
B.完全中和所需要相同浓度盐酸的体积:NaOH溶液小于氨水溶液
C.将两溶液温度均升高10℃,两溶液的pH仍相等
D.两种溶液中溶质的物质的量浓度相同难度: 中等查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH)>c(OH-)>c(H+)
B.10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol•L-1NaOH溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
用已知浓度的氢氧化钠溶液来滴定未知浓度的盐酸时,一定不会用到的仪器是( )
A.锥形锥
B.酸式滴定管
C.碱式滴定管
D.漏斗难度: 中等查看答案及解析
-
20mL 1mol/L 醋酸溶液与40mL 0.5mol/L氢氧化钠溶液相混合,所得溶液中各离子浓度关系正确的是( )
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)难度: 中等查看答案及解析