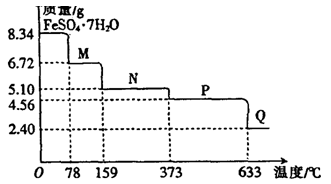
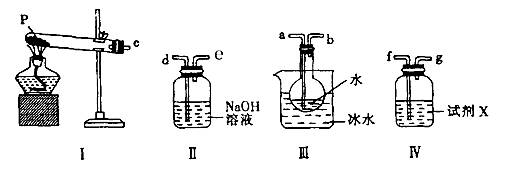
-
室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
难度: 简单查看答案及解析
-
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
难度: 简单查看答案及解析
-
“化学,我们的生活,我们的未来”是2011年“国际化学年”的主题。下列行为中不符合这一主题的是( )
A.控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
B.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
难度: 简单查看答案及解析
-
下列组合中在任何温度下反应均能自发进行的是( )
A.△H>0,△S>0 B.△H<0,△S<0
C.△ H>0,△ S<0 D.△ H<0,△ S>0
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-向右移动且溶液呈碱性的是( )
A.向水中通入氨气 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
难度: 简单查看答案及解析
-
已知某温度下,K(HCN)= 6.2×10-10 mol·L-1、K(HF)= 6.8×10-4 mol·L-1、K(CH3COOH)= 1.8×10-5 mol·L-1、、K(HNO2)= 6.4×10-6mol·L-1。物质的量浓度均为0.1 mol·L-1的下列溶液中,pH最小的是 ( )
A.NaCN B.NaF C.CH3COONa D.NaNO2
难度: 简单查看答案及解析
-
升高温度,下列数据不一定增大的是( )
A.化学反应速率v B.弱电解质的电离平衡常数Ka
C.化学平衡常数K D.水的离子积常数KW
难度: 简单查看答案及解析
-
反应2A(g)
2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是( )
A.减压 B.升温 C.加入合适的催化剂 D.增大B的浓度
难度: 简单查看答案及解析
-
在25℃时,用蒸馏水稀释0.1mol/L醋酸溶液到0.01mol/L,下列各项始终保持增大趋势的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是( )
A.明矾水解的离子方程式:Al3++3H2O
Al(OH)3+3H+
B.CaCO3(s)=CaO(s)+CO2(g) △S>0
C.用纯碱溶液洗涤餐具的原因,用离子方程式表示:CO32-+2H2O
H2CO3+2OH-
D.BaSO4悬浊液中存在平衡:BaSO4(s)
Ba2+(aq)+SO42-(aq)
难度: 简单查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失
D.滴定前读数正确,达到滴定终点后,俯视读数
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
B.在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7
C.0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比为1︰2
D.中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1∶2
难度: 简单查看答案及解析
-
下列各溶液中微粒的物质的量浓度关系错误的是( )
A.0.2mol/L K2CO3溶液中c(OH-)=c(HCO-3)+c(H+)+2c(H2CO3)
B.0.1mol/L NaHA溶液中其中pH=3,c(HA-)>c(H+)>c(H2A)>c(A2-)
C.向Na2SO4溶液中滴加稀CH3COOH得到pH=4的混合溶液c(Na+)=2c(SO2-4)
D.pH=a的HA溶液与pH=b的MOH溶液任意比混合c(H+)+c(M+)=c(OH-)+c(A-)
难度: 简单查看答案及解析
-
下列有关反应热的叙述正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为-241.8kJ/mol
B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
C.X(g)+Y(g)
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,
上述反应的△H增大
D.已知C(s)+O2(g)=CO2(g) △H1 , C(s)+1/2O2(g)=CO(g) △H2,
则△H1<△H2
难度: 简单查看答案及解析
-
已知:NaA水溶液呈碱性,常温下将0.10molNaA和0.05molHCl溶于水,得到PH<7的溶液,则溶液中离子浓度关系正确的是( )
A.c(A-)+c(OH-)=c(Na+)+c(H+) B.c(Na+)>c(A-)>c(H+)>c(OH-)
C.c(HA)+c(A-)=2c(Na+) D.c(Na+)>c(Cl-)>c(A-)>c(H+)
难度: 简单查看答案及解析
-
下列有关电化学的装置完全正确的是( )

难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,
B.反应Ⅱ:△H>0,
C.反应Ⅲ:△H>0 D.反应Ⅳ:△H<0,
难度: 简单查看答案及解析
-
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是( )
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以均Al(OH)3的形式存在
难度: 简单查看答案及解析