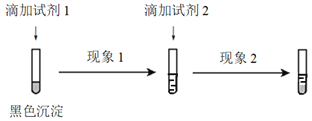
-
下列材料中属于有机高分子化合物的是
A
B
C
D




发动机及起落架材料——钛合金
航天服材料——
涤纶
战国初期的曾侯乙编钟——青铜器
日常生活中的餐具——陶瓷
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 属于糖类、油脂、蛋白质的物质均可发生水解反应
B. 乙酸和乙酸乙酯可用Na2CO3溶液加以区分
C. 室温下,在水中的溶解度:乙酸 >苯酚 >溴乙烷
D. 酚类物质具有还原性,有些可用作食品中的抗氧化剂
难度: 中等查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是
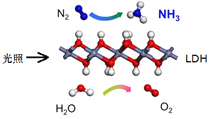
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
难度: 困难查看答案及解析
-
全世界每年因生锈损失的钢铁,约占世界年产量的十分之一。一种钢铁锈蚀原理示意图如右,下列说法不正确的是
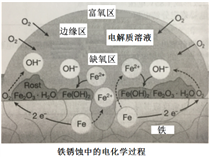
A. 缺氧区:Fe-2e-=== Fe2+
B. 富氧区:O2 + 2H2O + 4e-=== 4OH-
C. Fe失去的电子通过电解质溶液传递给O2
D. 隔绝氧气或电解质溶液均可有效防止铁生锈
难度: 中等查看答案及解析
-
结合下表数据分析,下列关于乙醇、乙二醇的说法,不合理的是
物质
分子式
沸点/℃
溶解性
乙醇
C2H6O
78.5
与水以任意比混溶
乙二醇
C2H6O2
197.3
与水和乙醇以任意比混溶
A. 二者的溶解性与其在水中能够形成氢键有关
B. 可以采用蒸馏的方法将二者进行分离
C. 丙三醇的沸点应该高于乙二醇的沸点
D. 二者组成和结构相似,互为同系物
难度: 中等查看答案及解析
-
在一定条件下发生下列反应,其中反应后固体质量增加的是
A. 氨气还原氧化铜 B. 二氧化锰加入过氧化氢溶液中
C. 次氯酸钙露置在空气中变质 D. 过氧化钠吸收二氧化碳
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量氨气
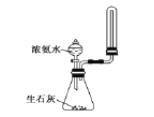
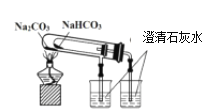
B. 比较NaHCO3和Na2CO3的热稳定性
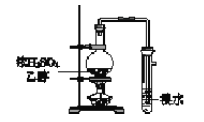
C. 制取并检验乙烯
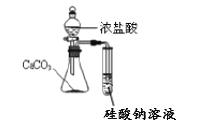
D. 比较盐酸、碳酸、硅酸的酸性强弱
难度: 困难查看答案及解析
-
下列解释事实的离子方程式不正确的是
A. 铝片放入NaOH溶液中有气体产生:2Al + 2OH-+ 2H2O===2AlO2-+3H2↑
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深: Cr2O72-(橙色) + H2O
2CrO42-(黄色) + 2H+
C. 向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32-+ CO2 + H2O === H2SiO3(胶体)+ CO32-
D. 用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32-
CaCO3 + SO42-
难度: 困难查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
选项
事实
推测
A
Mg与冷水较难反应,Ca与冷水较易反应
Be(铍)与冷水更难反应
B
Na与Cl形成离子键,Al与Cl形成共价键
Si与Cl形成共价键
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si是半导体材料,同族的Ge是半导体材料
ⅣA族元素的单质都是半导体材料
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
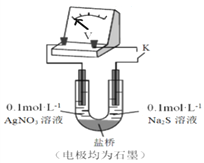
微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
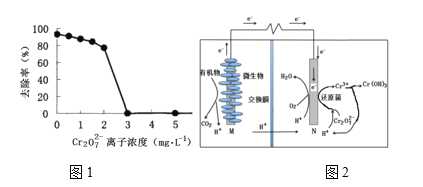
A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
难度: 困难查看答案及解析
-
将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应:CO(g) + H2O(g)
CO2(g) + H2(g),得到如下三组数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
CO
H2O
CO2
1
650
4
2
1.6
5
2
900
2
1
0.4
3
3
2
1
0.4
1
下列说法不正确的是
A. 该反应的正反应为放热反应
B. 实验1中,前5min用CO表示的速率为0.16 mol/(L·min)
C. 实验2中,平衡常数K=1/6
D. 实验3跟实验2相比,改变的条件可能是温度
难度: 困难查看答案及解析
-
聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如下:
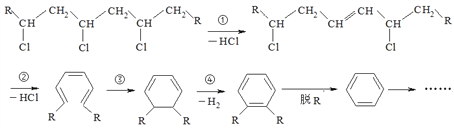
下列说法不正确的是
A. 聚氯乙烯的单体可由乙烯与HCl加成而得
B. 上述反应中①属于消去反应,④属于(脱氢)氧化反应
C. 火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D. 在火灾现场,可以用湿毛巾捂住口鼻,并弯下腰尽快远离现场
难度: 中等查看答案及解析
-
下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是
实验目的
试剂
烧杯中的物质
A
醋酸的酸性强于苯酚
碳酸氢钠溶液
①醋酸 ②苯酚溶液
B
羟基对苯环的活性有影响
饱和溴水
①苯 ②苯酚溶液
C
甲基对苯环的活性有影响
酸性高锰酸钾溶液
①苯 ②甲苯
D
乙醇羟基中的氢原子不如水分子中的氢原子活泼
金属钠
①水 ②乙醇
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH)
阴极现象
阳极现象
1 mol·L-1
产生无色气体
产生无色气体,10min内溶液颜色无明显变化
10 mol·L-1
产生大量无色气体
产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深
15 mol·L-1
产生大量无色气体
产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深
下列说法不正确的是
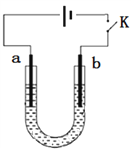
A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
难度: 困难查看答案及解析
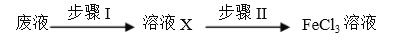
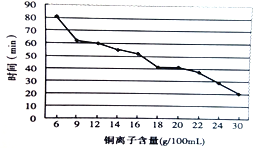
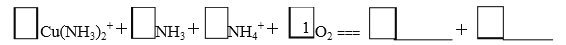
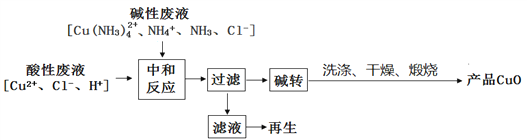
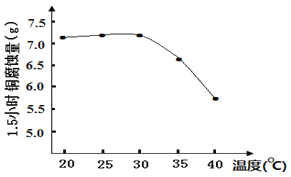
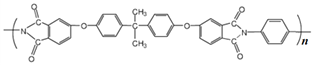 ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):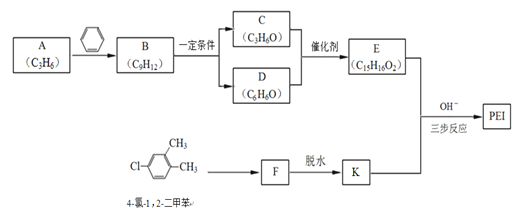

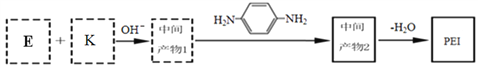
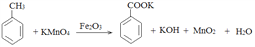 (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。