-
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48LHF,则转移0.8mol电子
D.还原剂与氧化剂的物质的量之比为1:4
难度: 简单查看答案及解析
-
化学已渗透到人类生活的各个方面,下列说法的错误是
A.交警检查司机是否酒后驾车的原理中体现了乙醇的还原性
B.14C可用于文物年代的鉴定,14C与12C互为同位素
C.铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
D.以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.硫化钠的电子式:
B.HClO4的电离方程式:HClO4
H++ClO4-
C.乙酸的结构简式:C2H4O2
D.Mg2+的结构示意图:
难度: 简单查看答案及解析
-
已知某有机物A分子式为C5H10O2,且能与NaHCO3溶液反应产生气体,则A的同分异构体数目共有(不考虑立体结构)
A.2种
B.3种
C.4种
D.5种
难度: 困难查看答案及解析
-
下列关于物质分类的说法正确的是
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②HF、HI都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰醋酸、四氧化三铁都不是混合物
⑤葡萄糖、油脂都不属于有机高分子化合物
A.④⑤
B.②④
C.①②
D.③⑤
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA
B.1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA
C.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
D.标况下,11.2LSO3所含的分子数目为0.5NA
难度: 中等查看答案及解析
-
下列有关工业合成氨的说法不能用平衡移动原理解释的是
A.不断补充氮气和氢气
B.选择20MPa-50MPa的高压
C.及时液化分离氨气
D.选择500℃左右同时使用铁触媒做催化剂
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0
B.使用催化剂能够降低化学反应的反应热(△H)
C.由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
难度: 简单查看答案及解析
-
原子结构决定元素的性质,下列说法中正确的是
A. Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小,
B. 在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C. 第二周期元素的最高正化合价都等于其原子的最外层电子数
D. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
难度: 中等查看答案及解析
-
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O (l)
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s)△H=+1.90k•Jmol-1可知,金刚石比石墨稳定
难度: 困难查看答案及解析
-
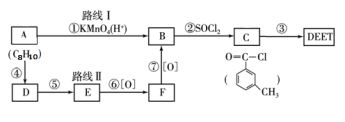
某有机物是药物生产的中间体,其结构简式如下图。下列有关叙述正确的是
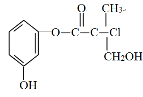
A.该有机物与溴水发生加成反应
B.该有机物与浓硫酸混合加热可发生消去反应
C.1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH
D.该有机物经催化氧化后能发生银镜反应
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,W与X同主族,Y的最外层电子数是电子层数的3倍,Y与W核外电子数相差6,Z的最外层电子数等于电子层数。下列说法正确的是
A. X、Y、W元素的原子半径依次递增
B. Z、W分别与Y形成的化合物均可作为耐高温材料
C. X、W分别与Y形成化合物在常温下均为气态
D. X、Z、W元素的最高价氧化物的水化物的酸性依次递增
难度: 中等查看答案及解析
-
我国“蛟龙”号载人潜水器进行第五次下潜试验,最大深度达到7062米,并安全返回。其动力电源是Al-AgO电池,原理如图所示。下列说法中正确的是
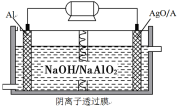
A.Al电极是该电池的正极
B.Ag在AgO/Ag电极上发生氧化反应
C.该电池负极反应是2Al-6e-+8OH-=2AlO2-+4H2O
D.AgO/Ag电极附近溶液中的pH减小
难度: 中等查看答案及解析
-
已知:Kw=1.0×10-14,Al(OH)3
AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
A.10
B.15
C.20
D.25
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.在0.1mol·L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1
C.向盐酸中加入氨水至中性,溶液中
D.在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-)
难度: 困难查看答案及解析
-
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4kJ/mol
B.-45.2kJ/mol
C.+69.4kJ/mol
D.+45.2kJ/mol
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O
B.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O
C.制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H
2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
难度: 中等查看答案及解析
-
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中c(K+)为4mol/L
B.电解后加入1molCu(OH)2可使溶液复原
C.电解后溶液中c(H+)为8mol/L
D.原溶液中c(Cu2+)为1mol/L
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)△H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
A.甲和乙中反应的化学平衡常数相同
B.乙和丙中的二氧化硫的生成速率相同
C.乙中SO2的体积分数大于丙
D.转化率:α甲(SO2)+α乙(SO3)<1
难度: 困难查看答案及解析
-
某恒温密闭容器发生可逆反应Z(?)+W(?)
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
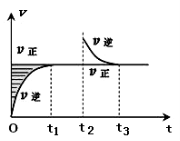
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
难度: 困难查看答案及解析