-
下列仪器名称错误的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列不属于物质分离、提纯实验操作用到的实验装置是( )
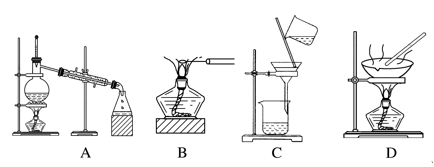
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用作食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2===2NaI+I2+2NO↑+2H2O。下列说法正确的是( )
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1∶1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
难度: 困难查看答案及解析
-
下列反应中,不属于四种基本反应类型的是( )
A. CuSO4+H2S===CuS↓+H2SO4
B. 2FeCl3+Cu===2FeCl2+CuCl2
C. Cu2(OH)2CO3
2CuO+CO2↑+H2O
D. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
难度: 中等查看答案及解析
-
下列溶液因水解而呈酸性的是( )
A. NaHSO4 B. CH3COONa
C. NH4Cl D. KI
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 漂白粉有效成分是氯酸钙
B. 液氯是纯净物,而氯水是混合物
C. 碘化钾水溶液能使淀粉变蓝
D. 氯气通入水中能置换出氢气
难度: 简单查看答案及解析
-
下列化学用语表述正确的是( )
A. 甲烷分子的球棍模型:
B. 氯化钠的电子式:
C. 氯气的比例模型:
D. 硫离子的结构示意图:
难度: 中等查看答案及解析
-
下列叙述合理的是( )
A. 用干燥的pH试纸检测碳酸钠溶液、氯水、稀醋酸的pH值
B. 铜与浓硫酸反应时,可用蘸有浓溴水的棉花放在导管口吸收逸出的气体
C. 需用某浓度的NaOH溶液450 mL,则配制时应选用450 mL的容量瓶
D. 将液溴、浓硝酸保存在棕色试剂瓶中,放置于冷暗处
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 淀粉溶液和蔗糖溶液都有丁达尔效应
B. 天然高分子化合物如糖类、油脂、纤维素都是人类重要的营养来源
C. 酶是具有催化作用的蛋白质,在光、热、酸、碱、重金属离子、乙醇等作用下会失去活性
D. 一定条件下,等物质的量的乙醇
和乙酸分别与足量的Na反应,乙酸产生的氢气体积多
难度: 中等查看答案及解析
-
下列实验方法或操作能达到实验目的的是( )
A.
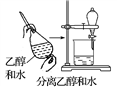 B.
B. 
C.
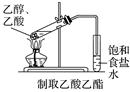 D.
D. 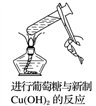
难度: 中等查看答案及解析
-
判断A(g)+B(g)
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A. 制作印刷电路板:Fe3++Cu===Cu2++Fe2+
B. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO
===BaSO4↓+2H2O
C. Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO
+2OH-===2CaCO3↓+2H2O+CO
D. 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O===Ca2++2Cl-+CO2↑+2HClO
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是( )
W
X
Y
Z
A. Z元素的最高价氧化物水化物的酸性强于Y
B. 由W元素形成的分子W2中存在三个共价键
C. 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定
D. 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18e-两种微粒
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 检验淀粉溶液可以用碘化钾溶液
B. 油脂在碱性条件下水解可以得到甘油和高级脂肪酸
C. 向蛋白质溶液中加入饱和氯化铜溶液有固体析出,加入一定量水后固体不会溶解
D. 乙烯使溴水褪色和使酸性高锰酸钾溶液褪色的原理是一样的
难度: 中等查看答案及解析
-
下列说法不正确的时( )
A. 煤的气化和干馏均属于化学变化
B. 植物的枝叶、水生植物、油料作物、动物粪便中蕴藏着丰富的生物质能
C. 氢气易液化,便于运输,且燃烧产物是水,是理想的清洁燃料
D. 大自然利用太阳能最有成效的是植物的光合作用
难度: 中等查看答案及解析
-
由A、B、C、D四种金属按表中装置进行实验,下列叙述中正确的是( )
实验装置与现象
装置
甲
乙
丙
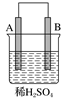
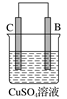
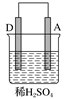
现象
A不断溶解
C的质量增加
A上有气体产生
A. 装置甲中的B金属是原电池的负极
B. 装置乙中的C金属是原电池的阴极
C. 装置丙中的D金属是原电池的正极
D. 四种金属的活泼性顺序是D>A>B>C
难度: 困难查看答案及解析
-
已知25 ℃时,某浓度NaCN(氰化钠)溶液pH=11,则下列有关说法中不正确的是( )
A. HCN的电离方程式:HCN
H++CN-
B. NaCN是一种弱电解质
C. NaCN溶液中一定存在:c(Na+)>c(CN-)
D. 0.1 mol·L-1NaCN溶液中:c(CN-)+c(HCN)=0.1 mol·L-1
难度: 困难查看答案及解析
-
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( )
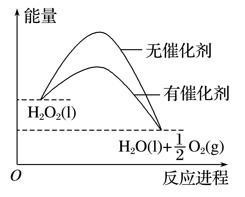
A. 加入催化剂,减小了反应的热效应
B. 该反应的热化学方程式:2H2O2(l)===2H2O(l)+O2(g) ΔH>0
C. 双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热
D. 该反应的反应物总能量高于生成物总能量
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. MgF2晶体中的化学键是共价键
B. 在共价化合物中一定存在共价键
C. N2和CH4两种分子中,每个原子的最外层都具有8电子稳定结构
D. 离子化合物一定只含离子键
难度: 中等查看答案及解析
-
在体积为1 L的密闭容器中(体积不变)充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )
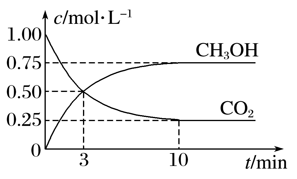
A. 3 min前v正>v逆,3 min后v正<v逆
B. 进行到3 min时,正反应速率和逆反应速率相等
C. 10 min后容器中各物质浓度不再改变
D. 达到平衡后,升高温度,正反应速率增大、逆反应速率减小
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 等质量的H2O与CH2D2含有的质子数相同
B. 室温下CH3COONH4溶液pH=7,1 L 0.1 mol·L-1该溶液中NH
离子数为0.1NA
C. 标准状况下,6.72 L NO2与水充分反应转移的电子数为0.2NA
D. 1 mol CH3COOC2H5在足量NaOH溶液中水解得到乙醇分子数为NA
难度: 中等查看答案及解析
-
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的HX,HY溶液,pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
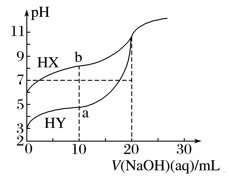
A. 当V(NaOH)=0 mL时,c(X-)>c(Y-)
B. a点时:c(Y-)+c(HY)=0.100 0 mol·L-1
C. b点时:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+)
D. 当V(NaOH)=20.00 mL时,NaX、NaY两溶液中的阴离子总数相对大小:N前者>N后者
难度: 困难查看答案及解析
-
已知氧化性Br2>Fe3+>I2,向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如下图所示,下列说法中正确的是( )
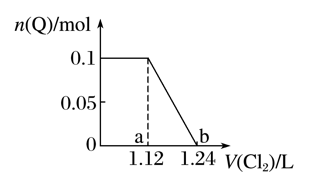
A. Q是I-
B. Q是Br-
C. b点时溶液中阴离子只有Cl-(不考虑OH-)
D. ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
难度: 困难查看答案及解析
-
某溶液中可能含有下列6种离子中的某几种:Cl-、SO
、CO
、NH
、Na+、K+。为了确认溶液的组成,进行了如下实验:
①取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。
②向①的滤液中加入足量的NaOH溶液,加热,产生能促使湿润的红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。关于原溶液组成的结论,不正确的是( )
A. c(NH
)>c(SO
)
B. 一定存在Cl-、SO
、CO
、NH
,一定不存在Na+、K+
C. c(CO
)=0.05 mol·L-1
D. 至少存在四种离子,且c(Cl-)≥0.05 mol·L-1
难度: 困难查看答案及解析
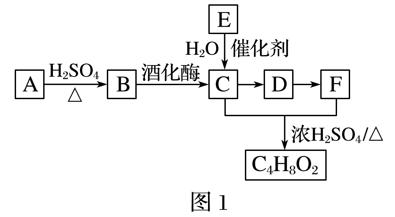
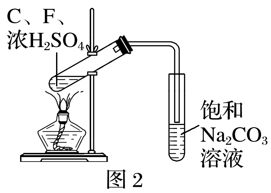
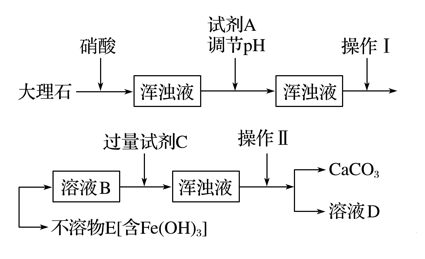
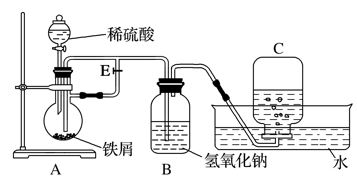
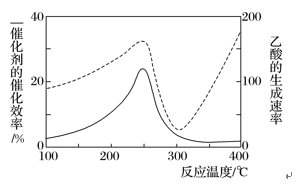
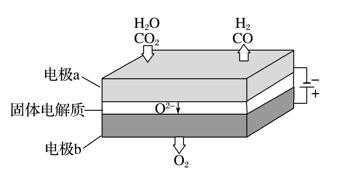
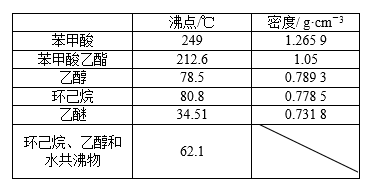
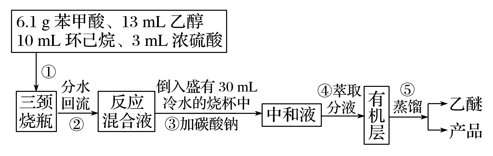
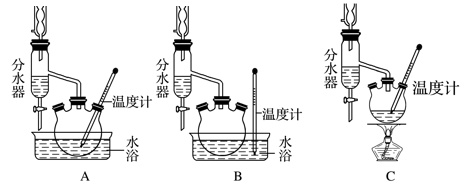
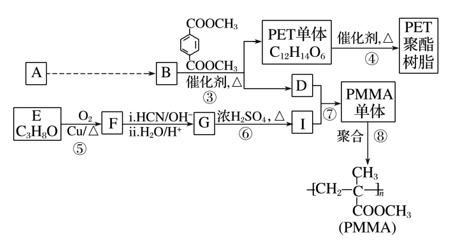
 RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)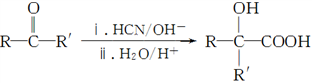 (R、R′代表烃基)请回答下列问题:
(R、R′代表烃基)请回答下列问题: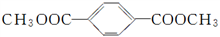 的同分异构体有多种,写出同时满足下列条件的同分异构体______________________________________________________________。
的同分异构体有多种,写出同时满足下列条件的同分异构体______________________________________________________________。