-
短周期主族元素W、X、Y、Z的原子序数依次增大,W与Y位于同一主族,X的原子半径是所有短周期主族元素中最大的。由W、Y和Z 三种元素形成的一种液态化合物甲溶于水后,可观察到剧烈反应,液面上有白雾形成,并有能使品紅溶液褪色的带刺激性气味的气体逸出。下列说法错误的是
A. Y的简单氢化物的热稳定性比Z的弱
B. W的简单离子半径大于X的简单离子半径
C. 化合物甲可用作某种锂电池的还原剂
D. XZW是漂白液的有效成分
难度: 中等查看答案及解析
-
下列生活用品中主要由黑色金属材料制造的是
A. 塑钢门窗 B. 不锈钢刀 C. 纯铜导线 D. 18K金首饰
难度: 简单查看答案及解析
-
通常检测SO2含量是否达到排放标准的反应原理是SO2 +H2O2 + BaCl2 ===BaSO4↓+ 2HCl。NA表示阿伏伽德罗常数,下列说法正确的是( )
A. 0.1 mol BaCl2晶体中所含微粒总数为0.1NA
B. 25 ℃时,pH =1的HCl溶液中含有H+的数目为0.1NA
C. 17 g H2O2中含有非极性键数目为0.5NA
D. 生成2.33 g BaSO4沉淀时,转移电子数目为0.01NA
难度: 中等查看答案及解析
-
工业上合成乙苯的反应为如下所示,下列说法正确的是
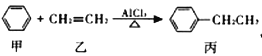
A. 甲、乙、丙均可以使酸性高锰酸钾溶液褪色 B. 该反应属于取代反应
C. 甲、乙均可通过石油分馏获取 D. 丙的一氯代物有5 种
难度: 中等查看答案及解析
-
某化学兴趣小组用下图装置探究硝酸银受热分解的产物,在a处充分加热固体后,b中观察到红棕色气体,d中收集到无色气体,a中残留黑色固体,下列叙述错误的是
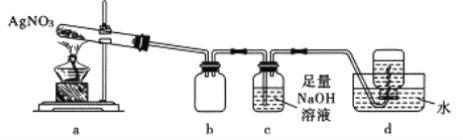
A. 装置a中残留的固体是Ag2O B. 装置b还起安全瓶的作用
C. 装置c中生成的盐含有NaNO3 D. 装置d 中的无色气体遇空气仍然是无色
难度: 中等查看答案及解析
-
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
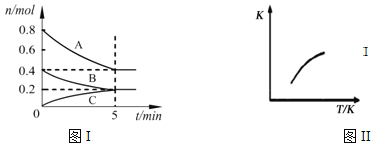
A. 该反应可表示为:2A(g)+B(g)
C(g)ΔH﹤0
B. t℃时该反应的平衡常数K=6.25
C. 当容器中气体密度不再变化时,该反应达到平衡状态
D. t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
难度: 中等查看答案及解析
-
在一定温度下,AgCl 与AgI的饱和溶液中存在如下关系,下列说法正确的是

A. AgCl(s) +I-(aq)
AgI(s) +Cl-(aq),在该温度下的平衡常数K=2.5×106
B. 向0.1mol/LKI溶液中加入AgNO3 溶液,当I-刚好完全沉淀时,c(Ag+ )=2×10-12mol/L
C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,可使溶液由A点变到B点
D. 向2 mL0.01mol/LAgNO3,溶液中加几滴0.01mol/L NaC1溶液,静置片刻,再向溶液中加几滴0.01mol/LKI溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
难度: 中等查看答案及解析
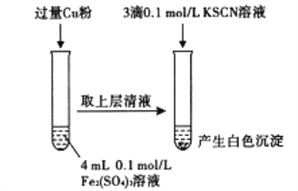
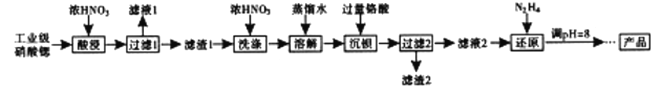
 溶液
溶液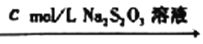 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)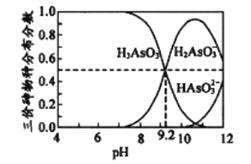
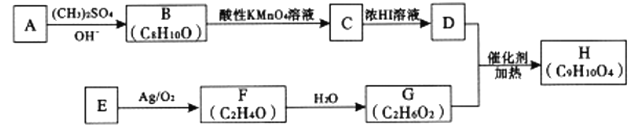
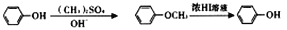
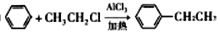
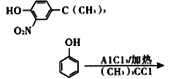 的合成路线(其他试剂任选);____________________
的合成路线(其他试剂任选);____________________