-
砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s) +  H2(g) +2O2(g) =H3AsO4(s) ΔHl
H2(g) +2O2(g) =H3AsO4(s) ΔHl
H2(g) +  O2(g) =H2O(1) ΔH2
O2(g) =H2O(1) ΔH2
As(s)+  O2(g)=
O2(g)=  As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(g) +3H2O(1) = 2H3AsO4(s) ΔH=_________。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________。
(3)NaH2AsO4溶液呈______(填“酸性”、“中性”或“碱性”),试通过计算说明________________________。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。
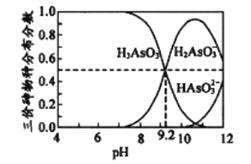
以酚酞为指示剂(变色范围pH8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________。
(5)某化学兴趣小组同学欲探究可逆反应AsO33-+I2+2OH- AsO43-+2I-+ H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
AsO43-+2I-+ H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
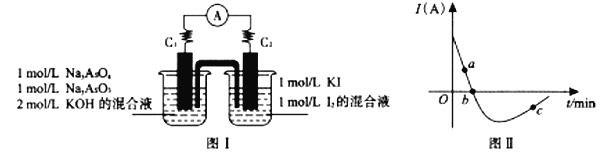
①图II中AsO43-的逆反应速率:a____b( 填“ >”、” <”或“ =” )。
②写出图II中c点对应图I装置的正极反应式__________________________。
③能判断该反应达到平衡状态的是________________。
a.2v(I-)正=v(AsO33-)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
-
砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+ O2(g)=
O2(g)= As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
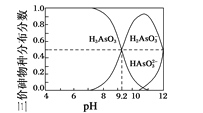
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH- AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
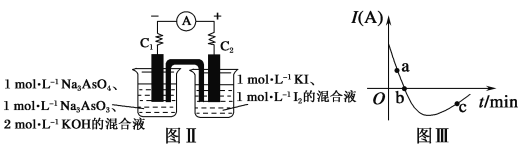
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
-
砷及其化合物用途非常广泛。回答下列问题:
(1)砷与磷同主族,原子序数比磷大18,则砷位于周期表第________周期__________族。
(2) H3AsO3(亚砷酸),是三元弱酸,第一步和第二步电离通过和水中的氢氧根结合实现的,第三步则直接电离出H+。第一步电离方程式为:H3AsO3+H2O [As(OH)4]-+H+,第二步的电离方程式为______________。
[As(OH)4]-+H+,第二步的电离方程式为______________。
(3)古代《本草衍义》提纯砒霜作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……,”该提纯用的基本操作______________。近年来发现砒霜(As2O3)可用于治疗白血病。砷黄铁矿(FeAsS)煅烧可生成砒霜和红棕色固体,该反应的化学方程式为__________________。
-
砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
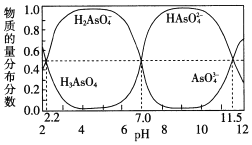
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s) 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)
 As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g) 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
| 反应Ⅱ | 反应Ⅲ |
| 活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
| 催化剂Y | 37 | 97 |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
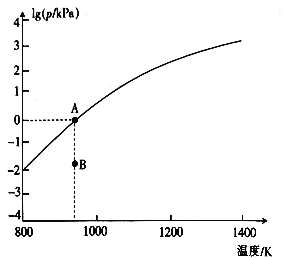
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
-
[2017·新课标Ⅲ]砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________________________。
(3)已知:As(s)+  H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+  O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+  O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
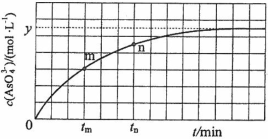
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I−)=2v( )
)
c.c( )/c(
)/c( )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
-
砷(As)原子序数为33,可以形成As2S3、As2O5、H3ASO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在周期表中的位置为第___周期___族。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。若反应生成6mol单质硫,则需要___molO2。该反应需要在加压下进行,原因是___。
(3)已知:As(s)+ H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+2O2(g)=H3ASO4(s) △H1
H2(g)+ O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+ O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应2H3AsO4(s)=As2O5(s)+3H2O(l)的△H=___。
(4)298K时,将10mL3xmol·L-1Na3AsO3、10mL3xmol·L-1I2和10mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
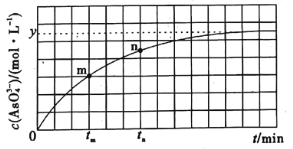
①下列可判断反应达到平衡的是___(填标号)。
a.v(OH-)=2v(AsO33-)
b.I2的浓度不再变化
c. 不再变化
不再变化
d.c(I-)=ymol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③图中m点和n点的逆反应速率较大的是___。
④若平衡时溶液的c(H+)=10-14mol/L,则该反应的平衡常数K为___。
-
(14分)
砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:AsO33−(aq)+I2(aq)+2OH− AsO43−(aq)+2I−(aq)+ H2O(l)。溶液中c(AsO43−)与反应时间(t)的关系如图所示。
AsO43−(aq)+2I−(aq)+ H2O(l)。溶液中c(AsO43−)与反应时间(t)的关系如图所示。
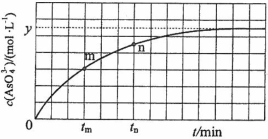
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I−)=2v(AsO33−)
c. c (AsO43−)/c (AsO33−)不再变化
d. c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
-
砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:AsO33−(aq)+I2(aq)+2OH− AsO43−(aq)+2I−(aq)+ H2O(l)。溶液中c(AsO43−)与反应时间(t)的关系如图所示。
AsO43−(aq)+2I−(aq)+ H2O(l)。溶液中c(AsO43−)与反应时间(t)的关系如图所示。
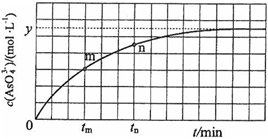
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I−)=2v(AsO33−)
c. c (AsO43−)/c (AsO33−)不再变化
d. c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
-
砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________________。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。
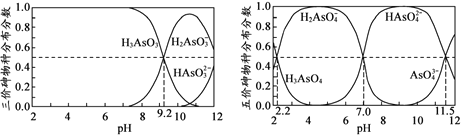
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 _____________________。 ②H3AsO4第一步电离方程式H3AsO4 H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________0(填“>”或“<”)。
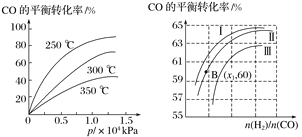
图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。
-
砷(As)与氮同一主族,As原子比N原子多两个电子层。可以形成As2S3、As2O5、H3AsO3、H3AsO4,等化合物,有着广泛的用途。回答下列问题:
(1)As的原子序数为______________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式____________。该反应需要在加压下进行,原因是___________。
(3)己知:As(s)+ H2(g)+2O2(g)=H3AsO4(s)
H2(g)+2O2(g)=H3AsO4(s) 
H2(g)+ O2(g)=H2O(l)
O2(g)=H2O(l) 
2As(s)+ O2(g)=As2O5(s)
O2(g)=As2O5(s) 
则反应As2O5(s)+3 H2O(l)=2 H3AsO4(s)的 =______________________。
=______________________。
(4)298K肘,将2OmL 3xmol·L-1 Na3AsO3、20m L3xmol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH- AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq) +2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
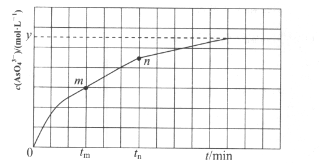
①下列可判断反应达到平衡的是_____(填标号)。
a.v(I-)=2v(AsO33-) b.溶液的pH不再变化
c.c(I-)=ymol·L-1 d.c(AsO43-)/c(AsO33-)不再变化
②tm时,v正____v逆(填“大于”、“小于”或“等于”)。
③) tm时v逆____tn时v逆(填“大于”、“小于”或“等于”),理由是___________。
④若平衡时溶液的pH=14,则该反应的平衡常数为_____(用x、y表示)。
H2(g) +2O2(g) =H3AsO4(s) ΔHl
O2(g) =H2O(1) ΔH2
O2(g)=
As2O5(s) ΔH3

AsO43-+2I-+ H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。











