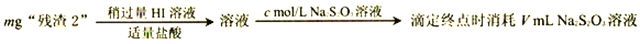-
高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
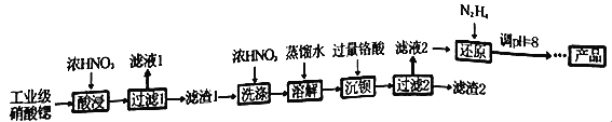
已知:①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为 BaCrO4(杂质不与硝酸反应)。②铬酸(H2CrO4)为弱酸。
(1)“酸浸”不能采用高温的原因是_________________________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_________________________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式_______________________________________________________。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全?______________________(列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是:___________。(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中 BaCrO4的含量,进行以下实验:
①判断Ba2+完全沉淀的方法:____________________________________________。
②“滤渣2”中BaCO4的质量分数为______________________(用代数式表示)。
-
高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
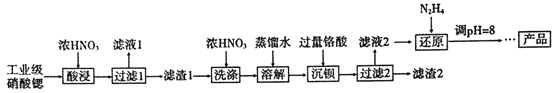
已知: ①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为BaCrO4
②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是_______。
(2)相对于水洗,用浓HNO3洗涤的优点是_______。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式____。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是_______(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
m g“滤渣2” 溶液
溶液 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①若加入的HI溶液过量太多,测定结果会_____(填“偏低”、“偏高”或“无影响”)。
②“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为_____(用代数式表示)。
-
高纯硝酸锶Sr(NO3)2 可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
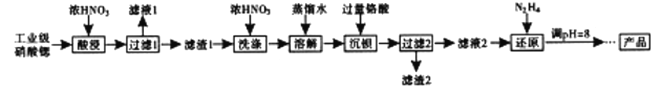
已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2 ②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________,“滤液1”的主要溶质是_____________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________。
(3)“滤液2”中过量的H2CrO4被N2H4 还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________。
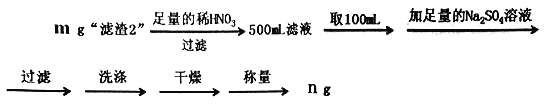
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液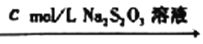 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______(“偏高”、“偏低”或“无影响”)。
-
高纯硝酸锶[Sr(NO3)2]可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如图:
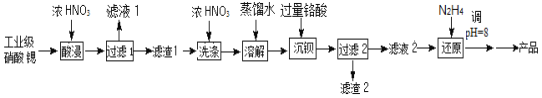
已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2;②铬酸(H2CrO4)为二元弱酸
(1)用铬酸(H2CrO4)“沉钡”,是工业上常用的方法。H2CrO4中Cr元素的化合价为__,其在水中的电离方程式为___。
(2)“酸浸”不能采用高温的原因是__,“滤液1”的主要溶质是__(写化学式)。
(3)相对于水洗,用浓HNO3洗涤的优点是__。
(4)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式__。
(5)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(用离子方程式说明理由)__。
-
高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是_________。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式_______________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为_________。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)_________(精确到0.01)。
-
高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是_________。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式_______________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为_________。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)_________(精确到0.01)。
-
高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
-
硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶[含Ca(NO3)2、Ba(NO3)2等杂质] 的提纯流程如下。(已知: 硝酸锶、硝酸钡不溶于浓硝酸)
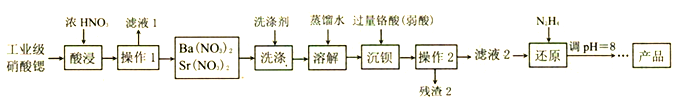
(1) 要加快“酸浸”速率所采取的措施是______(写一条即可)。
(2)操作1的名称是_______,洗涤所用的洗涤剂是______ .
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式______;氧化产物与还原产物的物质的量之比为______ 。
(4)已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是_______ 。
(5)为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)
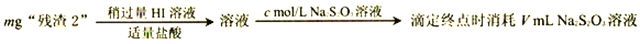
①“残渣2”中Cr元素的质量分数为______(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会是_____(填“偏高”、“偏低”或“无影响”),其原因是__________________。
-
高纯硝酸锶 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
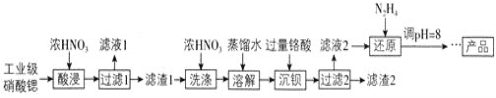
已知: 滤渣1的成分为
滤渣1的成分为 、
、 ;
; 铬酸
铬酸 为弱酸。
为弱酸。
 酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
酸浸不能采用高温的原因是____________,滤液1的主要溶质是________。
 相对于水洗,用浓硝酸洗涤的优点是___________。
相对于水洗,用浓硝酸洗涤的优点是___________。
 滤液2中过量的
滤液2中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:________。
,同时放出无污染的气体,写出发生反应的离子方程式:________。
 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由 __________。
__________。
 为了测定滤渣2中
为了测定滤渣2中 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2 溶液
溶液
滴定终点时消耗 溶液
溶液 已知:
已知: 。
。
 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为___________
的质量分数为___________ 用代数式表示
用代数式表示 。
。
 若加入的HI溶液过量太多,测定结果会_________
若加入的HI溶液过量太多,测定结果会_________ “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
-
(12分)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌。
② 。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。

 溶液
溶液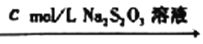 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)


 溶液
溶液